Como usar o Docetaxel Bergamo/Amgen?
Instruções de preparo
Recomendações para o manuseio seguro
Docetaxel é um agente antineoplásico, e assim como com outros compostos potencialmente tóxicos, deve-se ter cautela na manipulação e no preparo das soluções de Docetaxel. É recomendado o uso de luvas.
Caso a solução de Docetaxel concentrado ou solução para infusão entre em contato com a pele, lave a região imediata e completamente com água e sabão. Caso a solução de Docetaxel concentrado ou solução para infusão entre em contato com membranas mucosas, lave-as imediata e completamente com água.
Preparo da solução para administração intravenosa
Preparo da Solução para Infusão
Pode ser necessário mais do que um frasco de Docetaxel concentrado para infusão para se obter a dose necessária ao paciente. Retire assepticamente a quantidade necessária de solução concentrada (20 mg/mL) utilizando uma seringa calibrada com agulha de 21G.
Transfira este volume, através de uma injeção única, para uma bolsa ou frasco de infusão com 250 mL de solução glicosada a 5% ou solução de cloreto de sódio 0,9%.
Caso seja necessária uma dose maior que 200 mg de Docetaxel, utilize um volume superior de veículo de infusão, visando não exceder a concentração de 0,74 mg/mL de Docetaxel.
Misture o conteúdo da bolsa ou frasco de infusão manualmente, utilizando movimento oscilante.
A solução para infusão de Docetaxel deve ser administrada assepticamente por via intravenosa dentro de um período de 6 horas (incluindo 1 hora de infusão), em condições de temperatura ambiente abaixo de 25°C e luminosidade normal. Docetaxel deve ser administrado separadamente de outros medicamentos.
A solução para infusão de docetaxel é supersaturada, portanto, pode cristalizar com o tempo. Se aparecerem cristais, a solução não deve mais ser utilizada, devendo ser descartada.
Todos os materiais utilizados na diluição e administração devem ser descartados, seguindo procedimentos padrões.
Não é recomendado o contato do concentrado não diluído com equipamento ou dispositivos plastificantes de PVC utilizados para preparar soluções para infusão.
Instruções de preparo para utilizar Docetaxel 20 mg/1,0 ml ou 80 mg/4,0 ml - concentrado para infusão
Não utilize a formulação contendo dois frascos-ampola (concentrado para infusão e diluente) com a formulação contendo apenas um frasco-ampola (concentrado para infusão).
É importante que se leia atentamente esta instrução na sua totalidade antes do preparo da solução para infusão de Docetaxel.
Fórmula
Docetaxel concentrado para infusão é uma solução amarela clara a amarela-acastanhada, contendo 20 mg/mL de docetaxel em polissorbato 80 e álcool etílico (anidro) e ácido cítrico.
Apresentações
Docetaxel é apresentado em frascos-ampola.
Cada embalagem contém um frasco-ampola de Docetaxel 20 mg/1,0 mL ou Docetaxel 80 mg/4,0 mL solução concentrada para infusão.
Docetaxel deve ser conservado em temperatura ambiente inferior a 25°C, protegido da luz. Nestas condições, o prazo de validade é de 24 meses para Docetaxel 20 mg/1,0 mL e de 36 meses para Docetaxel 80 mg/4,0 mL.
Frasco-ampola de 20 mg/1,0 mL
- O frasco-ampola de Docetaxel 20 mg/1,0 mL é de vidro incolor de 7 mL, fechado com lacre de alumínio e tampa verde;
- O frasco-ampola de Docetaxel contém 20 mg de docetaxel (anidro) em 1,0 mL de solução 50/50 (v/v) de polissorbato 80/álcool etílico (anidro).
Frasco-ampola de 80 mg/4,0 mL
- O frasco-ampola de Docetaxel 80 mg/4,0 mL é de vidro incolor de 7 mL, fechado com lacre de alumínio e tampa magenta;
- O frasco-ampola de Docetaxel contém 80 mg de docetaxel (anidro) em 4,0 mL de solução 50/50 (v/v) de polissorbato 80/álcool etílico (anidro).
Recomendações para o manuseio seguro
Docetaxel é um agente antineoplásico e, assim como com outros compostos potencialmente tóxicos, deve-se ter cautela na manipulação e no preparo das soluções de Docetaxel. É recomendado o uso de luvas.
Caso a solução de Docetaxel concentrado ou solução para infusão entre em contato com a pele, lave a região imediata e completamente com água e sabão. Caso a solução de Docetaxel concentrado ou solução para infusão entre em contato com membranas mucosas, lave-as imediata e completamente com água.
Preparo da solução para administração intravenosa
Preparo da solução para infusão
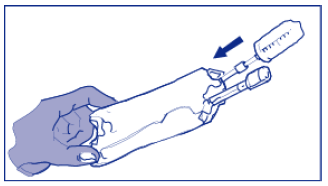
- Pode ser necessário mais do que um frasco de Docetaxel concentrado para infusão para se obter a dose necessária ao paciente. Retire assepticamente a quantidade necessária de solução concentrada (20 mg/mL) utilizando uma seringa calibrada com agulha de 21G.
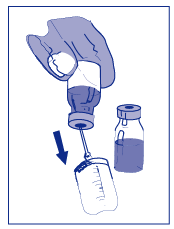
- Transfira este volume, através de uma injeção única, para uma bolsa ou frasco de infusão com 250 mL de solução glicosilada a 5% ou solução de cloreto de sódio 0,9%. Caso seja necessária uma dose maior que 200 mg de Docetaxel, utilize um volume superior de veículo de infusão, visando não exceder a concentração de 0,74 mg/mL de Docetaxel.
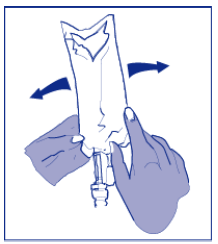
- Misture o conteúdo da bolsa ou frasco de infusão manualmente, utilizando movimento oscilante.
- Uma vez adicionada, conforme recomendações, à bolsa de infusão, a solução para infusão de Docetaxel, se armazenada abaixo de 25°C, é estável por 6 horas. A solução deve ser utilizada dentro de 6 horas (incluindo 1 hora de infusão intravenosa). A estabilidade física e química da solução para infusão em uso, preparada conforme recomendado, foi demonstrada em bolsas que não contêm PVC por até 48 horas quando armazenada entre 2° e 8°C.
- A solução para infusão de docetaxel é supersaturada, portanto, pode cristalizar com o tempo. Se aparecerem cristais, a solução não deve mais ser utilizada, devendo ser descartada.
Inutilização de materiais
Todos os materiais utilizados na diluição e administração de Docetaxel devem ser descartados seguindo procedimento padrão.
Posologia do Docetaxel
Informações Gerais
Uma pré-medicação com corticosteroide (veja a seguir para câncer de próstata) como 16 mg/dia (por exemplo 8 mg duas vezes ao dia) de dexametasona oral durante 3 dias, com início no dia anterior à administração de docetaxel, a menos que contraindicada, pode ser utilizada.
Para câncer de próstata metastático resistente à castração, determinado o uso associado de prednisona ou prednisolona, o regime de pré-medicação recomendado é dexametasona oral 8 mg, 12 horas, 3 horas e 1 hora antes da infusão de Docetaxel.
Para câncer de próstata metastático hormônio-sensível, independentemente do uso concomitante de prednisona ou prednisolona, a conduta pré-medicação recomendada é adminstração de dexametasona oral 8 mg, 12 horas, 3 horas e 1 hora antes da infusão de Docetaxel.
Pode ser utilizado o tratamento profilático com G-CSF para abrandar o risco de toxicidades hematológicas.
O docetaxel é administrado por infusão de 1 hora a cada 3 semanas.
Câncer de mama
Câncer de mama adjuvante
No tratamento adjuvante do câncer de mama operável de linfonodo positivo e de linfonodo negativo, a posologia recomendada de Docetaxel é de 75 mg/m2, administrada 1 hora após a administração de doxorrubicina 50 mg/m2 e ciclofosfamida 500 mg/m2, a cada 3 semanas durante 6 ciclos (regime TAC).
No tratamento adjuvante de pacientes com câncer de mama operável cujos tumores superexpressam HER2, a dose recomendada de Docetaxel é a seguinte:
AC-TH
- AC (ciclos 1 – 4): doxorrubicina (A) 60 mg/m2 seguida por ciclofosfamida (C) 600 mg/m2 administrada a cada três semanas por 4 ciclos.;
- TH (ciclos 5 – 8): docetaxel (T) 100 mg/m2 administrada a cada três semanas por 4 ciclos e trastuzumabe (H) administrada semanalmente conforme descrito abaixo:
- Ciclo 5 (iniciando três semanas após o último ciclo de AC):
- Dia 1: trastuzumabe 4 mg/kg (dose de ataque);
- Dia 2: docetaxel 100 mg/m2;
- Dias 8 e 15: trastuzumabe 2 mg/kg.
- Ciclos 6 – 8:
- Dia 1: docetaxel 100 mg/m2 e trastuzumabe 2 mg/kg;
- Dias 8 e 15: trastuzumabe 2 mg/kg;
- Três semanas após dia 1 do ciclo 8: trastuzumabe 6 mg/kg é administrado a cada três semanas.
- Ciclo 5 (iniciando três semanas após o último ciclo de AC):
Trastuzumabe é administrado por um total de duração de 1 ano.
TCH
- TCH (ciclos 1 – 6): docetaxel (T) 75 mg/m2 e carboplatina (C) com AUC de 6 mg/mL/min administrado a cada três semanas e trastuzumabe (H) administrado semanalmente conforme descrito abaixo:
- Ciclo 1:
- Dia 1: trastuzumabe 4 mg/kg (dose de ataque);
- Dia 2: docetaxel 75 mg/m2 e carboplatina com AUC de 6 mg/mL/min;
- Dias 8 e 15: trastuzumabe 2 mg/kg.
- Ciclos 2 – 6:
- Dia 1: docetaxel 75 mg/m2 seguido de carboplatina com AUC de 6 mg/mL/min e trastuzumabe 2 mg/kg;
- Dias 8 e 15: trastuzumabe 2 mg/kg;
- Três semanas após dia 1 do ciclo 6: trastuzumabe 6 mg/kg é administrado a cada três semanas.
- Ciclo 1:
Trastuzumabe é administrado por um total de duração de 1 ano.
Câncer de mama metastático
Em tratamento de primeira linha do câncer de mama, a posologia recomendada de docetaxel é de 75 mg/m2 na terapia associada com doxorrubicina 50 mg/m2.
Para a associação de Docetaxel e trastuzumabe, a posologia recomendada de Docetaxel é de 100 mg/m2 a cada três semanas, com trastuzumabe administrado semanalmente. Para a dosagem e administração de trastuzumabe, veja a bula do fabricante do produto à base de trastuzumabe.
Em tratamento de segunda linha do câncer de mama, a posologia recomendada de Docetaxel é de 100 mg/m2 em monoterapia.
Para pacientes em tratamento de câncer de mama, a posologia recomendada de Docetaxel em monoterapia é de 100 mg/m2, administrada em infusão de 1 hora, a cada 3 semanas.
A dose recomendada de Docetaxel é de 75 mg/m2 a cada três semanas, quando associada com capecitabina administrada por via oral a 1250 mg/m2 2 vezes ao dia (dentro de 30 minutos após a refeição) durante 2 semanas seguida por um período de 1 semana de descanso. Para a dose de capecitabina calculada de acordo com a área da superfície corpórea, veja as instruções recomendadas em bula pelo fabricante do produto à base de capecitabina. Em caso de terapia combinada, a posologia recomendada de Docetaxel é de 75 mg/m2 em associação com doxorrubicina (50 mg/m²).
Câncer de pulmão de não-pequenas células
Para os pacientes em tratamento de câncer de pulmão de não-pequenas células, a posologia recomendada de Docetaxel é de 75 a 100 mg/m2 em monoterapia, e de no máximo 75 mg/m2 em caso de associação com derivados de platina, administrada em infusão de 1 hora, a cada 3 semanas.
Câncer de ovário
Para pacientes em tratamento de câncer de ovário, a posologia recomendada de Docetaxel é de 100 mg/m2, administrada em infusão de 1 hora, a cada 3 semanas (vide Ajustes Posológicos e Modo de usar – Instruções de preparo). Os pacientes devem ser rigorosamente monitorados principalmente durante a primeira e a segunda infusões de Docetaxel, devido ao risco de reações de hipersensibilidade.
Câncer de próstata
Câncer de próstata metastático resistente à castração
A dose recomendada de Docetaxel é 75 mg/m2 a cada 3 semanas. Administrar continuamente prednisona ou prednisolona 5 mg, via oral, duas vezes ao dia.
Câncer de próstata metastático hormônio-sensível
A dose recomendada de Docetaxel é de 75 mg/m2 a cada 3 semanas durante 6 ciclos. Pode ser administrada continuamente prednisona ou prednisolona 10 mg por via oral diariamente.
Adenocarcinoma gástrico
Para adenocarcinoma gástrico, a dose recomendada de Docetaxel é 75 mg/m2 com 1 hora de infusão, seguida por cisplatina 75 mg/m2, com 1 a 3 horas de infusão (ambos somente no dia 1), seguida por fluoruracila 750 mg/m2 por dia administrado com infusão contínua de 24 horas por 5 dias, iniciando no final da infusão da cisplatina. O tratamento é repetido a cada três semanas. Os pacientes devem receber pré-medicação com antieméticos e hidratação apropriada para a administração de cisplatina. O G-CSF profilático deve ser utilizado para aliviar o risco de toxicidades hematológicas.
Câncer de cabeça e pescoço
Pacientes devem receber pré-medicação com antieméticos e hidratação apropriada (antes e após a administração de cisplatina). A profilaxia para as infecções neutropênicas deve ser administrada. Todos os pacientes no braço contendo Docetaxel dos estudos TAX 323 e TAX 324 receberam antibióticos profiláticos.
Indução por quimioterápicos seguida por radioterapia (TAX 323)
Para o tratamento de indução de carcinoma de células escamosas de cabeça e pescoço inoperável localmente avançado (SCCHN), a dose recomendada de Docetaxel é 75 mg/m2 por 1 hora de infusão seguida por cisplatina 75 mg/m2 superior a 1 hora no dia 1, seguida por fluoruracila em infusão contínua a 750 mg/m2 por dia, por 5 dias. Este regime é administrado a cada 3 semanas por 4 ciclos. Após a quimioterapia, os pacientes devem receber radioterapia.
Indução por quimioterápicos seguida por quimiorradioterapia (TAX 324)
Para o tratamento de indução em pacientes com SSCHN localmente avançado (não ressecável, cura cirúrgica baixa ou preservação do órgão), a dose recomendada de Docetaxel é 75 mg/m2 por 1 hora de infusão intravenosa no dia 1, seguida de cisplatina 100 mg/m2 administrada por 30 minutos a 3 horas de infusão, seguida por fluoruracila 1000 mg/m2 /dia em infusão contínua do dia 1 ao dia 4. Este regime é administrado a cada 3 semanas por 3 ciclos. Após a quimioterapia, os pacientes devem receber quimiorradioterapia.
Para modificações nas doses de cisplatina e fluoruracila, seguir as instruções da bula recomendadas pelo fabricante do produto.
Não há estudos dos efeitos de Docetaxel administrado por vias não recomendadas. Portanto, por segurança e para garantir a eficácia deste medicamento, a administração deve ser somente por via intravenosa.
Ajuste posológico durante o tratamento
Informações Gerais
Docetaxel não deve ser administrado até que a contagem neutrofílica seja > 1.500 células/mm³.
Os pacientes que apresentaram neutropenia febril, contagem de neutrófilos < 500 células/mm³ durante mais de uma semana, reações cutâneas severas ou cumulativas, ou sinais e/ou sintomas neurossensoriais severos durante a terapia com Docetaxel, deverão ter a dose reduzida de 100 mg/m² para 75 mg/m² e/ou de 75 mg/m² para 60 mg/m². Caso o paciente continue a apresentar as mesmas reações com a dose de 60 mg/m², o tratamento deve ser descontinuado.
Alternativamente, pode-se utilizar tratamento profilático com G-CSF em pacientes com neutropenia febril ou infecção severa anteriores, com o intuito de manter a intensidade da dose.
Terapia associada com Docetaxel para câncer de mama
Profilaxia primária com G-CSF deve ser considerada em pacientes que recebem terapia adjuvante com Docetaxel, doxorrubicina e ciclofosfamida (TAC) para câncer de mama. As pacientes que apresentam neutropenia febril e/ou infecção neutropênica devem ter suas doses de Docetaxel reduzidas a 60 mg/m2 em todos os ciclos subsequentes. As pacientes que apresentam estomatite de Grau 3 ou 4 devem ter suas doses diminuídas para 60 mg/m2.
As pacientes que receberam terapia adjuvante com AC-TH ou TCH para câncer de mama operável cujos tumores superexpressam HER2 e que apresentam um episódio de infecção ou neutropenia febril, devem receber G-CSF profilático em todos os ciclos subsequentes. Para um segundo episódio de infecção ou neutropenia febril, as pacientes devem continuar com G-CSF profilático e Docetaxel será reduzido de 100 mg/m2 a 75 mg/m2 (no regime AC-TH); Docetaxel será reduzido de 75 mg/m2 a 60 mg/m2 (no regime TCH).
Entretanto, na prática clínica, a neutropenia poderia ocorrer no ciclo 1. Deste modo, G-CSF deve ser utilizado em consideração ao risco neutropênico da paciente nas recomendações atuais. Dependendo do regime de tratamento, as pacientes que apresentam estomatite de Grau 3 ou 4, devem ter sua dose diminuída de 100 mg/m2 para 75 mg/m2 (no regime AC-TH) ou de 75 mg/m2 para 60 mg/m2 (no regime TCH).
Para as alterações na dose de capecitabina quando associada com docetaxel, veja as instruções recomendadas em bula pelo fabricante do produto à base de capecitabina. Para pacientes que estão desenvolvendo a primeira ocorrência de toxicidade de Grau 2 a qual persista até o próximo tratamento com Docetaxel/capecitabina, postergar o tratamento até apresentar toxicidade de Grau 0-1 e retomar 100% da dose original. Para pacientes que estão desenvolvendo a segunda ocorrência de toxicidade de Grau 2 ou a primeira ocorrência de toxicidade de Grau 3, em qualquer período durante o ciclo de tratamento, postergar o tratamento até apresentar toxicidade de Grau 0-1, depois retomar o tratamento com Docetaxel na dose de 55 mg/m2.
Para qualquer ocorrência subsequente de toxicidade ou qualquer toxicidade de Grau 4, descontinuar a dose de Docetaxel.
Para as alterações na dose de Docetaxel devido à insuficiência hepática, vide "Quais cuidados devo ter ao usar o Docetaxel?".
Associação com Docetaxel para câncer de pulmão de não-pequenas células
Para pacientes que receberam inicialmente Docetaxel 75 mg/m2 em combinação com cisplatina e cujo nadir da contagem plaquetária durante o período anterior ao tratamento foi < 25.000 células/mm3 ou em pacientes que apresentaram neutropenia febril, ou em pacientes com toxicidades não-hematológicas sérias, a dose de Docetaxel em ciclos subsequentes deve ser reduzida para 65 mg/m2. Para os ajustes de dose da cisplatina, seguir as instruções da bula recomendadas pelo fabricante do produto.
Terapia associada de Docetaxel com cisplatina e fluoruracila para câncer gástrico ou câncer de cabeça e pescoço
Os pacientes tratados com Docetaxel em associação com cisplatina e fluoruracila devem receber antieméticos e hidratação apropriada de acordo com as normas institucionais atuais. O G-CSF deve ser administrado para aliviar o risco de complicações relacionadas à neutropenia.
Apesar da utilização do G-CSF, se ocorrer um episódio de neutropenia febril, neutropenia prolongada ou infecção neutropênica, a dose de Docetaxel deve ser reduzida de 75 para 60 mg/m2. Caso ocorram episódios subsequentes de neutropenia complicada, a dose de Docetaxel deve ser reduzida de 60 para 45 mg/m2. No caso de trombocitopenia grau 4, a dose de Docetaxel deve ser reduzida de 75 para 60 mg/m2. Os pacientes não devem ser tratados novamente com ciclos subsequentes de Docetaxel até que os neutrófilos se restabeleçam para um nível > 1.500 células/mm3 e as plaquetas se restabeleçam para um nível > 100.000 células/mm3. Interromper o tratamento se estas toxicidades persistirem.
Modificações na dose recomendada para as toxicidades em pacientes tratados com Docetaxel em associação com cisplatina e fluoruracila (5-FU):
| Toxicidade | Ajuste na dose |
| Diarreia grau 3 | Episódio 1: reduzir a dose 5-FU em até 20% |
Episódio 2: depois reduzir a dose de Docetaxel em até 20% | |
| Diarreia grau 4 | Episódio 1: reduzir as doses de Docetaxel e 5-FU em até 20% |
Episódio 2: interromper o tratamento | |
| Estomatite/ mucosite grau 3 | Episódio 1: reduzir a dose de 5-FU em até 20% |
Episódio 2: interromper apenas a dose de 5-FU em todos os ciclos subsequentes | |
Episódio 3: reduzir a dose de Docetaxel em até 20% | |
| Estomatite/ mucosite grau 4 | Episódio 1: interromper apenas a dose de 5-FU em todos os ciclos subsequentes |
Episódio 2: reduzir a dose de Docetaxel em até 20% |
Para ajustes na dose de cisplatina e fluoruracila, verificar na bula dos respectivos produtos.
Populações especiais
Pacientes com insuficiência hepática
Com base nos dados farmacocinéticos obtidos com a administração de 100 mg/m2 de Docetaxel em monoterapia, a dose recomendada para pacientes que apresentam simultaneamente aumento de transaminases (TGP e/ou TGO) > 1,5 vezes o limite superior da normalidade e de fosfatase alcalina > 2,5 vezes o limite superior da normalidade é de 75 mg/m2. Em pacientes com nível plasmático de bilirrubina maior do que o limite superior da normalidade e/ou níveis de TGP e TGO > 3,5 vezes o limite superior da normalidade associado a níveis de fosfatase alcalina > 6 vezes o limite superior da normalidade, não se deve realizar ajuste posológico e Docetaxel não deve ser utilizado, a menos que estritamente indicado. Não existem dados disponíveis em pacientes com insuficiência hepática tratados com Docetaxel em terapia combinada.
Crianças
A eficácia e segurança da administração de Docetaxel em crianças ainda não foram estabelecidas.
Idosos
Com base na análise farmacocinética desta população, não há necessidade de instruções especiais na administração de Docetaxel em idosos. Para a redução na dose de capecitabina quando associada com docetaxel, ver as instruções recomendadas em bula pelo fabricante do produto à base de capecitabina.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)