Para que serve o Dalinvi SC?
Dalinvi® SC é usado para:
- Com bortezomibe, talidomida e dexametasona em pacientes recém-diagnosticados com mieloma múltiplo, que podem fazer transplante autólogo de células-tronco.
- Com lenalidomida e dexametasona ou bortezomibe, melfalana e prednisona em pacientes recém-diagnosticados com mieloma múltiplo que não podem fazer transplante autólogo de células-tronco.
- Com lenalidomida e dexametasona ou pomalidomida e dexametasona ou bortezomibe e dexametasona em pacientes com mieloma múltiplo que já fizeram pelo menos um tratamento anterior.
- Com carfilzomibe e dexametasona, para pacientes com mieloma múltiplo que fizeram de uma a três terapias anteriores.
- Sozinho, em pacientes com mieloma múltiplo que fizeram pelo menos três terapias anteriores, incluindo inibidor de proteassoma e agente imunomodulador, ou que não responderam a esses medicamentos.
- Para tratar pacientes com amiloidose de cadeia leve (AL).
Como o Dalinvi SC age no organismo?
Dalinvi® SC contém daratumumabe, que pertence ao grupo de "anticorpos monoclonais". Ele age ligando-se a células sanguíneas anormais, ajudando seu sistema de defesa a destruí-las.
Quem não pode usar o Dalinvi SC?
Não use se já teve reação alérgica grave a daratumumabe, hialuronidase humana recombinante ou qualquer componente da fórmula.
Como aplicar o Dalinvi SC?
Dalinvi® SC é aplicado por profissional de saúde como injeção sob a pele (subcutânea) por 3 a 5 minutos. Aplicado na barriga (abdome), evitando áreas vermelhas, machucadas ou com cicatrizes. Se sentir dor, a injeção pode ser interrompida e continuada em outra área.
Pacientes usando daratumumabe intravenoso podem mudar para Dalinvi® SC na próxima dose programada.
Dose e frequência
A dose é de 1.800 mg. Seu médico determinará o horário da aplicação.
Dalinvi® SC pode ser usado sozinho ou com outros remédios para mieloma múltiplo ou amiloidose AL.
O esquema de aplicação geralmente segue:
- Uma vez por semana nas primeiras 8 semanas.
- Depois, uma vez a cada 2 semanas por 16 semanas.
- Depois, uma vez a cada 4 semanas, até progressão da doença ou efeitos graves.
Quando combinado com outros remédios, seu médico ajustará o intervalo entre doses.
Medicamentos usados durante o tratamento
Você pode receber remédios para prevenir reativação do vírus herpes zoster.
Antes de cada aplicação, receberá medicamentos para reduzir reações à injeção.
Estes podem incluir:
- Anti-alérgicos (anti-histamínicos).
- Anti-inflamatórios (corticosteroides).
- Remédios para febre (como paracetamol).
Após cada aplicação, receberá corticosteroides para reduzir reações.
Pacientes com problemas respiratórios
Se tiver asma ou DPOC, receberá medicamentos inalados:
- Broncodilatadores (abrem as vias aéreas) e corticosteroides (reduzem inflamação).
Siga as orientações do médico sobre horários, doses e duração do tratamento. Não pare sem orientação médica.
Use corretamente. Em dúvidas, consulte o farmacêutico. Se sintomas persistirem, procure seu médico.
O que fazer se perder uma dose do Dalinvi SC?
É importante receber todas as doses no horário. Se perder uma aplicação, remarcar a consulta o mais rápido possível.
Em dúvidas, consulte o farmacêutico ou seu médico.
Precauções ao usar o Dalinvi SC
Converse com seu médico antes de usar Dalinvi® SC.
Reações à injeção
Antes e após cada aplicação, você receberá medicamentos para reduzir reações. Essas reações são mais comuns na primeira aplicação e geralmente ocorrem no mesmo dia. Reações tardias podem surgir até 3-4 dias após. Se tiver reação grave, o médico pode interromper o tratamento.
Reações alérgicas graves podem incluir inchaço no rosto, lábios, língua ou garganta, dificuldade para engolir ou respirar, ou coceira intensa (urticária).
Informe imediatamente seu médico se tiver qualquer reação listada na seção "Efeitos colaterais do Dalinvi SC?".
Se tiver reações, poderá precisar de outros remédios ou interrupção das aplicações. Quando melhorar, o tratamento pode ser retomado.
Transfusões de sangue
Se precisar de transfusão, avise que está usando Dalinvi® SC, pois ele pode afetar exames de compatibilidade sanguínea.
Destruição de glóbulos vermelhos (hemólise)
Há baixo risco de hemólise. Monitoramento contínuo está sendo feito.
Diminuição de glóbulos brancos e plaquetas
Dalinvi® SC pode reduzir glóbulos brancos (combatem infecções) e plaquetas (coagulam sangue). Informe seu médico se tiver febre, hematomas ou sangramentos.
Hepatite B
Informe se já teve hepatite B. Dalinvi® SC pode reativar o vírus. Seu médico fará exames antes, durante e após o tratamento. Informe imediatamente se sentir cansaço extremo ou pele/olhos amarelados.
Crianças e adolescentes
Não use em menores de 18 anos.
Gravidez
Informe ao médico se está grávida, suspeita ou planeja engravidar.
Se engravidar durante o tratamento, informe imediatamente. Você e seu médico avaliarão riscos e benefícios. Adie vacinas vivas em bebês expostos ao remédio durante a gravidez até avaliação hematológica.
A combinação com lenalidomida, talidomida ou pomalidomida é proibida em grávidas, pois pode causar má formação fetal ou morte. Consulte a bula desses medicamentos.
Prevenção da gravidez
Mulheres em tratamento devem usar métodos contraceptivos durante e por 3 meses após o tratamento.
Amamentação
Converse com seu médico, pois o remédio pode passar para o leite e os efeitos no bebê são desconhecidos.
Dirigir e operar máquinas
Você pode sentir cansaço após usar Dalinvi® SC, o que pode afetar essas atividades.
Este remédio não deve ser usado por grávidas sem orientação médica.
Medicamentos imunossupressores podem reativar tuberculose. Médicos devem monitorar pacientes para diagnóstico precoce.
Efeitos colaterais do Dalinvi SC
Como todo remédio, Dalinvi® SC pode causar efeitos colaterais, embora nem todos os pacientes os tenham.
Reações à injeção
- Informe imediatamente seu médico se tiver sinais de reação até 3-4 dias após a aplicação:
Muito comum (mais de 10% dos pacientes)
- Calafrios; dor de garganta; tosse; enjoo; vômito; coceira; nariz escorrendo ou entupido; falta de ar.
Comum (1% a 10% dos pacientes)
- Desconforto no peito; tontura; pressão baixa; chiado no peito.
Raro (até 0,1% dos pacientes)
- Reação alérgica grave com inchaço no rosto, lábios, boca, língua ou garganta, dificuldade para engolir ou respirar, coceira intensa; dor nos olhos; visão embaçada.
Se tiver qualquer reação acima, informe seu médico imediatamente.
Reações no local da aplicação
- Comum (1% a 10% dos pacientes): vermelhidão, coceira, inchaço, dor, hematoma, erupção ou sangramento no local da injeção.
Outros efeitos colaterais
Muito comum (mais de 10% dos pacientes)
- Febre.
- Cansaço.
- Diarreia.
- Prisão de ventre.
- Falta de apetite.
- Insônia.
- Dor de cabeça.
- Formigamento, dormência ou dor.
- Espasmos musculares.
- Dor nas articulações.
- Erupção na pele.
- Inchaço nas mãos, tornozelos ou pés.
- Fraqueza.
- Dor nas costas.
- Pneumonia.
- Bronquite.
- Infecções no nariz, seios nasais ou garganta.
- Anemia (baixos glóbulos vermelhos).
- Baixos glóbulos brancos.
- Baixas plaquetas.
Comum (1% a 10% dos pacientes)
- Batimento cardíaco irregular.
- Líquido nos pulmões.
- Infecção urinária.
- Infecção generalizada grave (sepse).
- Desidratação.
- Açúcar alto no sangue.
- Cálcio baixo no sangue.
- Baixos anticorpos (hipogamaglobulinemia).
- Tontura.
- Desmaio.
- Dor muscular no peito.
- Gripe.
- Arrepios.
- Coceira.
- Formigamento na pele.
- Inflamação no pâncreas.
- Pressão alta.
Incomum (0,1% a 1% dos pacientes)
- Infecção por citomegalovírus.
- Inflamação no fígado (hepatite).
- Covid-19.
Atenção: este produto tem nova forma de aplicação e fórmula no país. Podem ocorrer efeitos desconhecidos. Informe seu médico.
Apresentações do Dalinvi SC
Solução Injetável 120 mg/mL
Embalagem com 1 frasco de 15 mL.
Uso subcutâneo.
Para adultos.
O que contém o Dalinvi SC?
Cada frasco contém:
1.800 mg de daratumumabe em 15 mL de solução.
Outros componentes: hialuronidase humana recombinante, histidina, cloridrato de histidina monoidratado, levometionina, polissorbato 20, sorbitol, água para injetáveis.
Este medicamento contém hialuronidase humana recombinante (rHuPH20), que facilita a absorção e dispersão do remédio no tecido subcutâneo.
Superdose: riscos de dose excessiva do Dalinvi SC
Este remédio é aplicado por profissional de saúde. Em caso de dose acima do recomendado, a equipe médica saberá como proceder.
Em caso de uso excessivo, procure socorro médico e leve a embalagem. Ligue para 0800 722 6001.
Interação com outros remédios: Dalinvi SC
Informe ao profissional de saúde todos os remédios que usa, incluindo vitaminas e fitoterápicos.
Informe seu médico sobre outros medicamentos em uso.
Não use remédios sem orientação médica. Pode ser perigoso.
Como a substância de Dalinvi SC age?
Resultados de Eficácia
Mieloma Múltiplo recém diagnosticado
Combinação com bortezomibe, melfalana e prednisona (VMP) para pacientes inelegíveis a transplante
Estudo clínico comparou Daratumumabe + VMP vs VMP em pacientes recém-diagnosticados. Daratumumabe foi administrado em dose específica com outros medicamentos. Pacientes tratados com D-VMP tiveram maior sobrevida livre de progressão (redução de 50% no risco de progressão ou morte).
Figura 1: Curva de Sobrevida Livre de Progressão
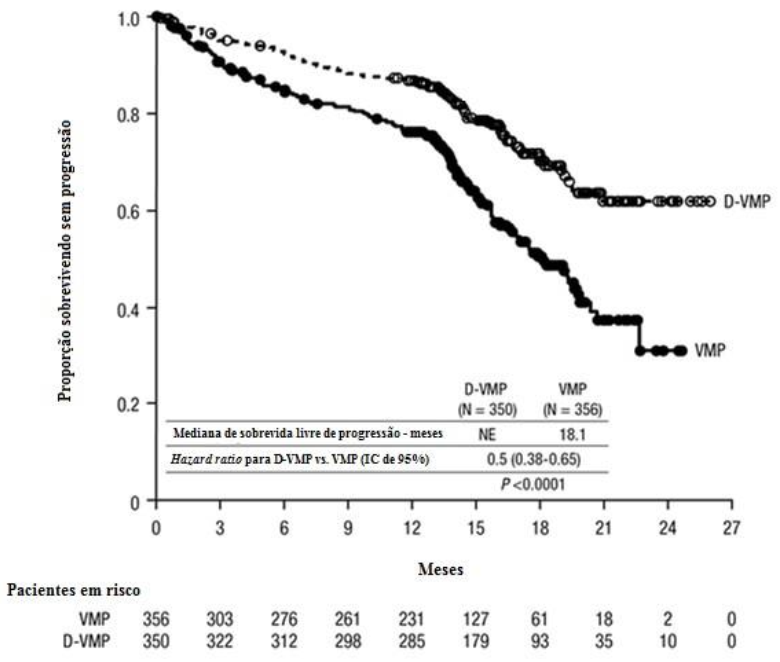
Resultados adicionais mostraram maior taxa de resposta global e doença residual mínima negativa no grupo D-VMP.
| D-VMP (n=350) | VMP (n=356) | |
Resposta global; n(%) | 318 (90,9) | 263 (73,9) |
Valor de p | < 0,0001 | - |
Resposta completa rigorosa n(%) | 63 (18,0) | 25 (7,0) |
Resposta completa n(%) | 86 (24,6) | 62 (17,4) |
Resposta parcial muito boa n(%) | 100 (28,6) | 90 (25,3) |
| Resposta parcial n(%) | 69 (19,7) | 86 (24,2) |
| Taxa de DRM negativa (IC 95%) (%) | 22,3 (18,0-27,0) | 6,2 (3,9-9,2) |
| Odds ratio (IC 95%) | 4,36 (2,64-7,21) | - |
| Valor de p | < 0,0001 | - |
D-VMP = daratumumabe-bortezomibe-melfalana-prednisona; VMP = bortezomibe melfalana-prednisona; DRM = doença residual mínima; IC = intervalo de confiança.
Tempo médio para resposta foi rápido em ambos os grupos.
Mieloma Múltiplo recidivado / refratário
Combinação com bortezomibe
Estudo comparou Daratumumabe + bortezomibe/dexametasona (DVd) vs bortezomibe/dexametasona (Vd) em pacientes com pelo menos um tratamento prévio. Pacientes tratados com DVd tiveram maior sobrevida livre de progressão (redução de 61% no risco).
Figura 2: Curva de Sobrevida Livre de Progressão
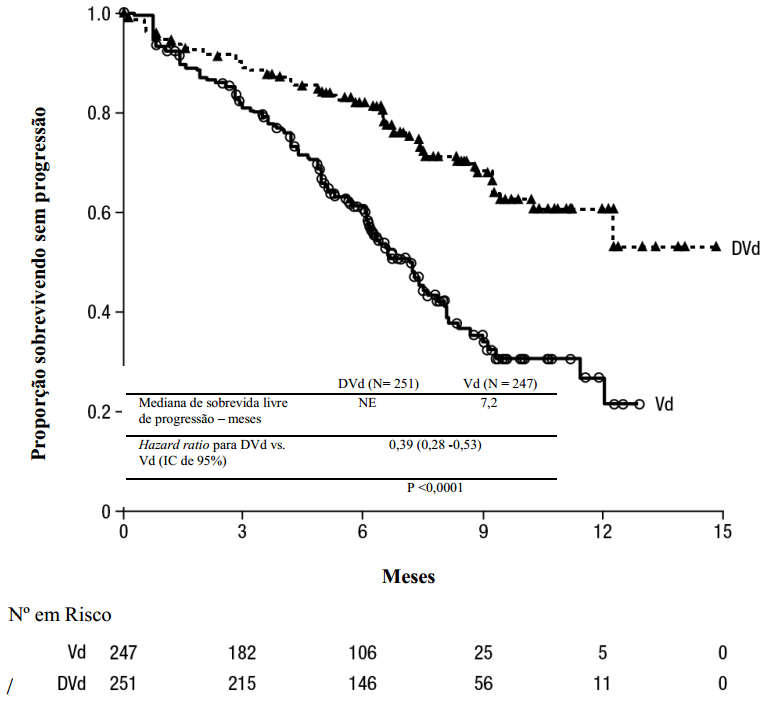
Resultados adicionais mostraram maior taxa de resposta global e doença residual mínima negativa no grupo DVd.
| Pacientes com resposta avaliável | DVd (n=240) | Vd (n=234) |
Resposta global n(%) | 199 (82,9) | 148 (63,2) |
Valor de p | < 0,0001 | - |
Resposta completa rigorosa | 11 (4,6) | 5 (2,1) |
Resposta completa | 35 (14,6) | 16 (6,8) |
Resposta parcial muito boa | 96 (40,0) | 47 (20,1) |
| Resposta parcial | 57 (23,8) | 80 (34,2) |
| Tempo médio para resposta [meses] | 0,9 | 1.6 |
| Duração média da resposta [meses] | NE | 7,9 |
| Taxa de DRM negativa (IC 95%) (%) | 13,5 | 2,8 |
| Odds ratio (IC 95%) | 5,37 | - |
| Valor de p | 0,000006 | - |
DVd = Daratumumabe- bortezomibe-dexametasona; Vd = bortezomibe dexametasona; DRM= doença residual mínima; NE = não estimável.
Monoterapia
Daratumumabe em monoterapia mostrou eficácia em pacientes com mieloma refratário. Taxa de resposta global foi de 29,2% em um estudo e 36% em outro.
| Resultado | Daratumumabe 16 mg/kg N=106 |
| Taxa de resposta global [n(%)] | 31 (29,2) |
| Resposta completa rigorosa [n (%)] | 3 (2,8) |
| Resposta completa [n] | 0 |
| Resposta parcial muito boa [n (%)] | 10 (9,4) |
| Resposta parcial [n (%)] | 18 (17,0) |
| Taxa de Benefício Clínico [n(%)] | 36 (34,0) |
| Duração média da resposta [meses] | 7,4 |
| Tempo médio para resposta [meses] | 1 |
Combinação com lenalidomida
Estudo comparou Daratumumabe + lenalidomida/dexametasona (DRd) vs lenalidomida/dexametasona (Rd) em pacientes com pelo menos um tratamento prévio. Pacientes tratados com DRd tiveram maior sobrevida livre de progressão (redução de 63% no risco).
Figura 3: Curva de Sobrevida Livre de Progressão
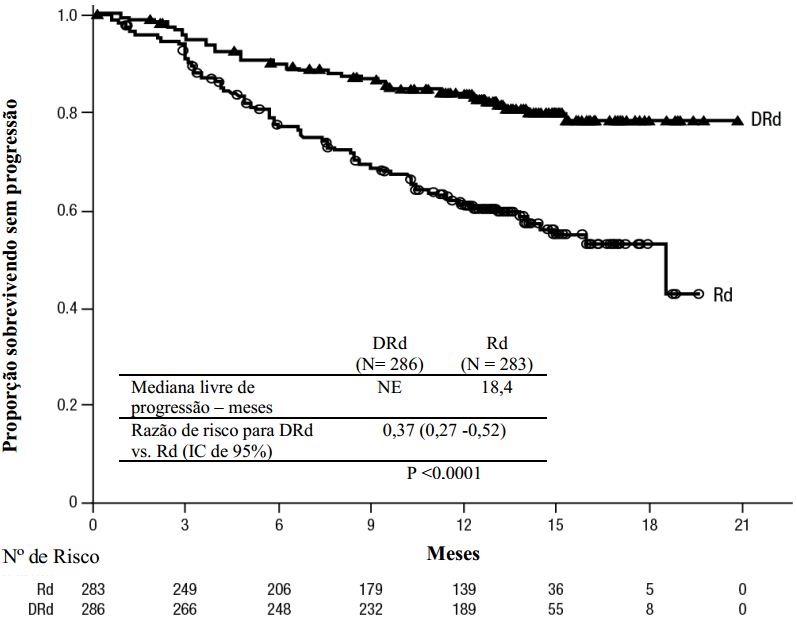
Resultados adicionais mostraram maior taxa de resposta global e doença residual mínima negativa no grupo DRd.
| Pacientes com resposta avaliável | DRd (n=281) | Rd (n=276) |
Resposta global n(%) | 261 (92,9) | 211 (76,4) |
Valor de p | < 0,0001 | - |
Resposta completa rigorosa | 51 (18,1) | 20 (7,2) |
Resposta completa | 70 (24,9) | 33 (12,0) |
Resposta parcial muito boa | 92 (32,7) | 69 (25,0) |
| Resposta parcial | 48 (17,1) | 89 (32,2) |
| Tempo médio para resposta [meses] | 1,0 | 1,3 |
| Duração média da resposta [meses] | NE | 17,4 |
| Taxa de MRD negativa (IC 95%) (%) | 29,0 | 7,8 |
| Razão de probabilidade | 4,85 | - |
| Valor de p | <0,000001 | - |
DRd = Daratumumabe-lenalidomida-dexametasona; Rd = lenalidomida dexametasona; MRD= doença residual mínima; NE = não estimável.
Referências:
1. Palumbo A, et al. N Engl J Med. 2016;375(8):754-66.
2. Lokhorst HM, et al. N Engl J Med. 2015;373(13):1207-1219.
3. Lonial S, et al. Lancet. 2016;387(10027):1551-1560.
4. Dimopoulos MA, et al. N Engl J Med. 2016;375(14):1319-1331.
Características Farmacológicas
Como age
Mecanismo de ação
Daratumumabe é um anticorpo monoclonal que se liga à proteína CD38, presente em células de doenças hematológicas. Ele inibe o crescimento de células tumorais e induz morte celular através de múltiplos mecanismos.
Como o corpo processa o remédio
A farmacocinética de Daratumumabe foi estudada em pacientes com mieloma. Concentrações aumentam com doses múltiplas. Meia-vida terminal média após primeira dose de 16 mg/kg é de 9 dias.
O peso corporal influencia a depuração, por isso o tratamento é ajustado por peso.
Grupos especiais
Idade e gênero
Idade (31-93 anos) e gênero não afetam clinicamente a farmacocinética.
Problemas renais
Insuficiência renal não altera clinicamente a exposição ao remédio.
Problemas hepáticos
Insuficiência hepática não altera clinicamente a exposição ao remédio.
Raça
Exposição similar em brancos e não-brancos.
Estudos não clínicos
Câncer e mutações
Estudos não realizados, pois proteínas grandes não interagem com DNA.
Reprodução
Não foram realizados estudos em animais.
Armazenamento do Dalinvi SC
Guarde Dalinvi® SC na geladeira (2 °C – 8 °C). Antes de usar, deixe em temperatura ambiente (15 °C – 30 °C). O frasco fechado pode ficar em temperatura ambiente por até 24 horas. Proteger da luz. Não agitar.
Verifique o lote e validade na embalagem.
Não use após o vencimento. Mantenha na embalagem original.
Validade após preparo
Se a seringa preparada não for usada imediatamente, pode ser guardada na geladeira por até 24 horas, seguido por até 7 horas em temperatura ambiente (15°C-30°C). Descartar se não usado nesse período. Se refrigerada, deixar atingir temperatura ambiente antes de usar.
Aspecto físico
Solução incolor a amarela, transparente a opalescente.
Antes de usar, verifique o aspecto. Se houver alteração, consulte o farmacêutico.
Mantenha fora do alcance de crianças.
Alertas do Dalinvi SC
Atenção: Estas informações referem-se apenas ao Dalinvi® SC.
Informações legais do Dalinvi SC
MS - 1.1236.3414
Farm. Resp.:
Erika Diago Rufino
CRF/SP n° 57.310
Registrado por:
Janssen-cilag Farmacêutica Ltda.
Avenida Presidente Juscelino Kubitschek, 2.041
São Paulo – SP
CNPJ 51.780.468/0001-87
Fabricado por:
Cilag AG
Schaffhausen - Suíça
Importado por:
Janssen-Cilag Farmacêutica Ltda.
Rodovia Presidente Dutra, Km 154
São José dos Campos – SP
CNPJ 51.780.468/0002-68
®Marca registrada.
Uso restrito em hospitais.
Venda sob prescrição médica.

 Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.
Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.