Como o Brineura age no organismo?
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo terapêutico: Enzimas para distúrbios metabólicos.
Código ATC: A16AB17.
Mecanismo de ação
A alfacerliponase é uma forma recombinante da enzima humana TPP1. É uma pró-enzima inativada que se torna ativa nos lisossomos. A enzima é absorvida pelas células e direcionada aos lisossomos através de receptores específicos.
A enzima ativada decompõe tripéptidos de proteínas-alvo. A falta de TPP1 causa CLN2, levando à neurodegeneração.
Resultados clínicos
Eficácia e segurança foram avaliadas em estudos com pacientes CLN2 comparados a grupo controle. Utilizou-se escala específica que avalia função motora (0-3 pontos) e de linguagem (0-3 pontos), total máximo 6 pontos.
Tabela 3: Escala de avaliação clínica na CLN2
| Domínio | Pontuação | Classificação |
| Motor | 3 | Marcha normal sem quedas |
| 2 | Caminha 10 passos sem apoio, mas com instabilidade | |
| 1 | Precisa de ajuda para andar ou só rasteja | |
| 0 | Não anda nem rasteja | |
| Linguagem | 3 | Linguagem normal para idade |
| 2 | Linguagem anormal, frases curtas para necessidades | |
| 1 | Poucas palavras compreensíveis | |
| 0 | Sem palavras compreensíveis |
24 pacientes (3-8 anos) receberam 300mg a cada 2 semanas. A pontuação média inicial foi 3.5. Comparados ao grupo controle, 87% não tiveram declínio de 2 pontos após 48 semanas.
Tabela 4: Taxa de declínio após 48 semanas
| Taxa de declínio (pontos/48 semanas)a | Total (n = 23) | Valor pb |
| Média (DP) | 0,40 (0,809)c | < 0,0001 |
| Mediana | 0,00 | |
| Mín., máx. | -0,88; 2,02 | |
| Limites do IC de 95% | 0,05; 0,75 |
a Variação na pontuação por 48 semanas.
b Comparado com declínio esperado de 2 pontos.
c Valores positivos indicam piora; negativos indicam melhora.
Figura 2: Alteração média na pontuação CLN2 (Grupo controle vs. tratados)
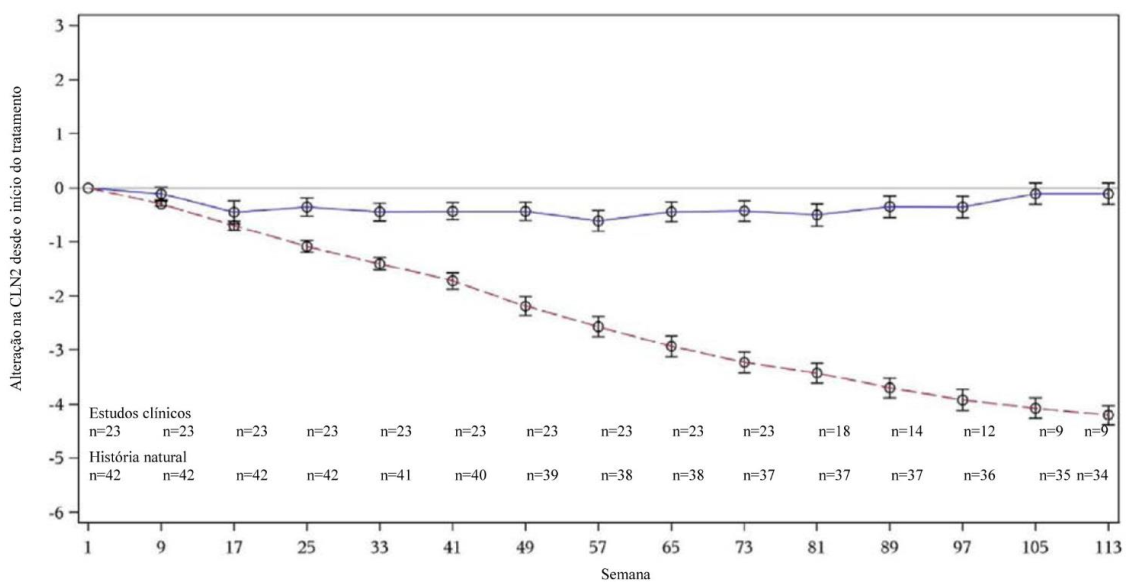
Linha contínua: estudos clínicos. Linha tracejada: Grupo controle histórico.
Uso em crianças
O tratamento deve começar cedo, embora não haja dados suficientes para menores de 3 anos. Um estudo em andamento avalia segurança em recém-nascidos até 18 anos.
Propriedades farmacocinéticas
Farmacocinética avaliada em pacientes CLN2 recebendo 300mg intracerebroventricular a cada 2 semanas.
Tabela 5: Propriedades farmacocinéticas no líquido cefalorraquidiano (LCR)
| Parâmetro | LCR (N=17) / Média (DP) |
| Tmáx.*, h | 4,50 [4,25; 5,75] |
| Cmáx., µg/mL | 1490 (942) |
| AUC0–t, µg·h/mL | 9510 (4130) |
| Vd, mL | 435 (412) |
| Cl, mL/h | 38,7 (19,8) |
| t1/2, h | 7,35 (2,90) |
* Tempo medido desde início da infusão
Distribuição
O volume de distribuição sugere que parte do medicamento atinge tecidos além do LCR, porém a maior concentração permanece no sistema nervoso central.
Eliminação
A alfacerliponase é metabolizada por hidrólise peptídica. Função hepática comprometida não deve afetar sua farmacocinética.
Excreção
A eliminação renal é considerada secundária.
Estudos pré-clínicos
Dados limitados de segurança foram obtidos em estudos com primatas e cães. Devido a limitações metodológicas, esses resultados não permitem prever completamente a segurança em humanos.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)