Para que serve o Bozemyb?
Este medicamento é utilizado para tratar pessoas com mieloma múltiplo nas seguintes situações:
- Pacientes que nunca foram tratados e não podem receber quimioterapia intensiva com transplante de medula óssea. Nestes casos, o medicamento é combinado com melfalana e prednisona.
- Pacientes que já passaram por pelo menos um tratamento anterior.
Contraindicações do Bozemyb
Não utilize este medicamento se tiver alergia ao Bortezomibe, boro ou manitol.
Gravidez (Categoria D)
Mulheres em idade fértil devem evitar engravidar durante o tratamento.
Não use este medicamento durante a gestação sem orientação médica. Informe seu médico imediatamente se suspeitar de gravidez.
Como usar o Bozemyb?
Pode ser aplicado por injeção na veia (intravenosa) ou sob a pele (subcutânea).
Atenção: a via subcutânea só pode ser usada para este medicamento.
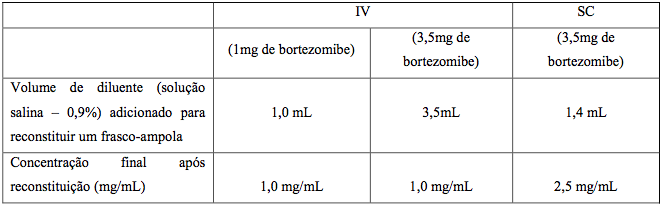
Cada forma de aplicação requer diferentes volumes de solução salina para reconstituição. Após preparo, a concentração para aplicação subcutânea (2,5 mg/mL) é maior que para intravenosa (1,0 mg/mL).
Como cada via tem concentrações diferentes, é essencial calcular cuidadosamente o volume a ser aplicado.
A embalagem contém etiquetas que indicam a via de aplicação. Cole-as no frasco e na seringa durante o preparo para evitar erros.
O conteúdo de cada frasco deve ser reconstituído apenas com solução salina normal (0,9%), conforme as instruções:
A injeção intravenosa deve ser rápida (3-5 segundos), por cateter venoso, seguida de lavagem com solução salina.
Para aplicação subcutânea, injete na coxa ou abdome, alternando os locais. Evite áreas lesionadas ou inflamadas.
Se ocorrerem reações no local, pode-se usar concentração menor (1 mg/mL) por via subcutânea ou mudar para intravenosa.
Mantenha intervalo mínimo de 72 horas entre as aplicações.
Houve casos fatais por aplicação na coluna vertebral. Use apenas pelas vias intravenosa ou subcutânea.
Nunca aplique na coluna vertebral.
Uso isolado
Mieloma Múltiplo Recorrente
Dose recomendada
Dose padrão: 1,3 mg/m2 duas vezes por semana durante duas semanas (Dias 1, 4, 8 e 11), seguido de descanso de 10 dias (ciclo de 21 dias).
Após 8 ciclos, pode-se manter com aplicações semanais (Dias 1, 8, 15 e 22) e descanso de 13 dias (ciclo de 35 dias).
Respeite intervalo mínimo de 72 horas entre doses.
Pacientes com resposta completa confirmada podem receber até 8 ciclos.
Ajustes de dose e retomada
Interrompa ao surgir toxicidade não hematológica Grau 3 ou hematológica Grau 4. Após melhora, reinicie com redução de 25% na dose.
Para neuropatia periférica, siga as recomendações abaixo:
Tabela 12: Ajustes de dose para dor neuropática e neuropatia sensorial
| Intensidade dos sintomasa | Ajuste na dose |
| Grau 1 (sem dor ou limitação) | Sem alteração |
| Grau 1 com dor ou Grau 2 (limitação moderada) | Reduzir para 1,0 mg/m2 ou mudar para aplicação semanal |
| Grau 2 com dor ou Grau 3 (limitação grave) | Suspender até melhora, depois reiniciar com 0,7 mg/m2 semanal |
| Grau 4 (risco de vida) | Interromper tratamento |
a Classificação conforme critérios do NCI CTCAE v 4.
b Limitação moderada: impacto em atividades como cozinhar ou usar telefone.
c Limitação grave: impacto em autocuidados como vestir-se ou alimentar-se.
Nota: Reduções de dose podem diminuir a eficácia do tratamento.
Combinação com outros medicamentos
Mieloma múltiplo não tratado - Pacientes não elegíveis a transplante
Dose com melfalana e prednisona
Administrar com melfalana e prednisona por 9 ciclos de 6 semanas. Nos ciclos 1-4: aplicações duas vezes por semana. Nos ciclos 5-9: aplicações semanais.
Tabela 13: Esquema posológico combinado para pacientes sem tratamento prévio
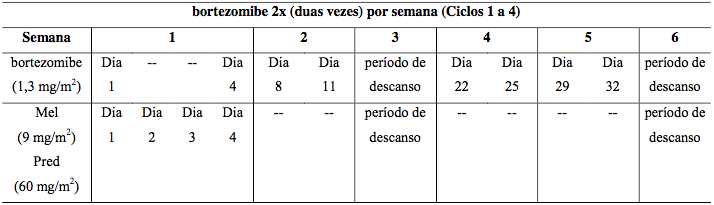
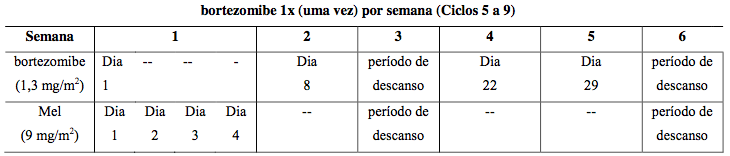

Mel = melfalana, Pred = prednisona.
Guia para combinação com melfalana e prednisona
Antes de iniciar novo ciclo:
- Plaquetas ≥ 70 x 109/L e neutrófilos ≥ 1,0 x 109/L.
- Toxicidade não-hematológica resolvida até Grau 1.
Tabela 14: Ajustes de dose durante ciclos subsequentes
Toxicidade | Ação |
Efeitos hematológicos: | |
Neutropenia ou trombocitopenia Grau 4 prolongada | Reduzir melfalana em 25% no próximo ciclo |
Plaquetas ≤ 30 x 109/L ou neutrófilos ≤ 0,75 x 109/L no dia da dose | Suspender Bozemyb |
Múltiplas doses suspensas no mesmo ciclo | Reduzir dose do Bozemyb |
Toxicidade não-hematologica ≥ Grau 3 | Suspender Bozemyb até melhora, depois reiniciar com dose reduzida |
Para informações sobre melfalana e prednisona, consulte as bulas específicas.
Siga as mesmas diretrizes de ajuste de dose do uso isolado.
Dose para pacientes não tratados elegíveis a transplante
Combinação com dexametasona
Administrar 1,3 mg/m2 por via intravenosa duas vezes por semana por 4 ciclos (Dias 1, 4, 8 e 11), com descanso de 10 dias.
Dexametasona oral 40 mg nos Dias 1-4 e 8-11 de cada ciclo.
Combinação com dexametasona e talidomida
Mesmo esquema anterior, com ciclos de 4 semanas. Recomenda-se 2 ciclos adicionais para resposta parcial ou melhor.
Talidomida oral iniciando com 50 mg/dia, podendo aumentar progressivamente até 200 mg/dia conforme tolerância.
Tabela 15: Esquema para pacientes elegíveis a transplante
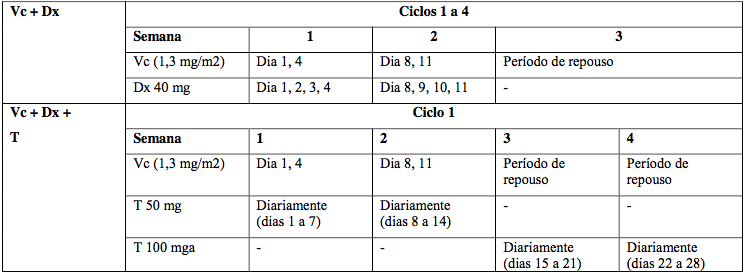
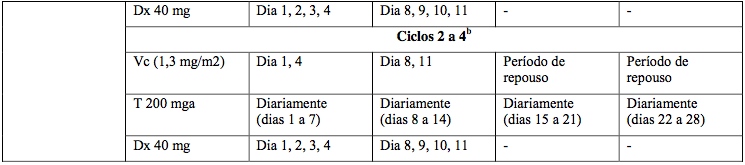
Vc = Bortezomibe; Dx = dexametasona; T = talidomida.
a Aumento gradual da talidomida conforme tolerância.
b Até 6 ciclos para resposta satisfatória.
Talidomida é teratogênica. Siga rigorosamente o programa de prevenção de gestação. Consulte bula específica.
Ajustes para pacientes elegíveis a transplante
Para neuropatia, consulte Tabela 1.
Considere reduções apropriadas para outros medicamentos conforme suas bulas.
Grupos especiais
Pacientes com problemas renais
Não é necessário ajuste de dose. Administre após sessões de diálise.
Pacientes com problemas hepáticos
Iniciar com 0,7 mg/m2 no primeiro ciclo. Aumentos ou reduções podem ser considerados conforme tolerância.
Tabela 16: Ajustes para insuficiência hepática
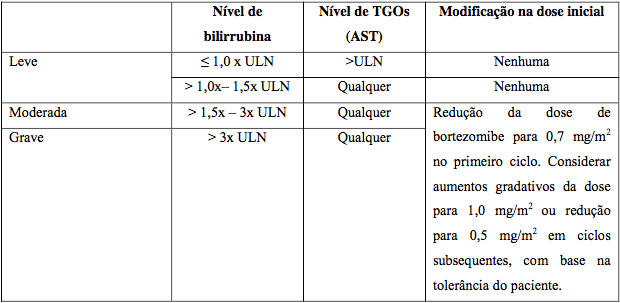
Abreviações: TGOS = transaminase glutâmico oxoloacética sérica; AST = aspartato aminotransferase; ULN = acima do limite normal.
Precauções ao usar o Bozemyb
Use sob supervisão médica especializada.
Houve casos fatais por aplicação na coluna vertebral. Use apenas pelas vias intravenosa e subcutânea.
NUNCA APLIQUE NA COLUNA VERTEBRAL.
O perfil de segurança é similar entre uso isolado e combinação com outros medicamentos.
Neuropatia periférica
Pode causar danos nervosos predominantemente sensoriais. Casos graves de neuropatia motora foram relatados.
Pacientes com sintomas prévios podem apresentar piora. Monitore sensação de queimação, formigamento, fraqueza ou desconforto.
A via subcutânea apresenta menor incidência de neuropatia grave comparada à intravenosa.
Melhora pode ocorrer após ajuste de dose, mudança de esquema ou via de aplicação.
Pressão baixa
Pode causar quedas de pressão. Cuidado em pacientes com histórico de desmaios, desidratação ou uso de medicamentos para pressão.
Reposição de líquidos e uso de medicamentos podem ser necessários.
Problemas cardíacos
Relatados casos de piora de insuficiência cardíaca ou redução da função cardíaca. Monitore pacientes com doenças cardíacas.
Alterações hepáticas
Raros casos de falência hepática. Outros efeitos incluem aumento de enzimas hepáticas e hepatite.
Problemas pulmonares
Relatados casos raros de pneumonite e síndrome do desconforto respiratório. Alguns foram fatais.
Avalie rapidamente novos sintomas respiratórios.
Exames de sangue
Monitore hemograma regularmente durante o tratamento.
Plaquetas baixas / Glóbulos brancos baixos
Associado a redução de plaquetas e neutrófilos. O nível mais baixo ocorre no Dia 11 de cada ciclo.
Monitore plaquetas antes de cada dose. Suspenda se plaquetas < 25.000/mcL. Transfusões podem ser necessárias.
Tabela 11: Gravidade da trombocitopenia relacionada à contagem inicial
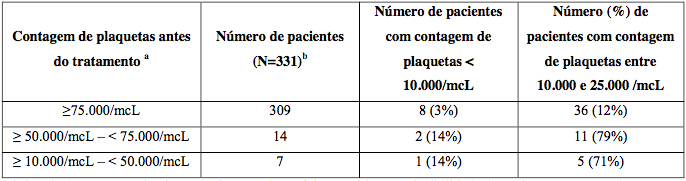
a Níveis basais ≥50000/mcL exigidos para inclusão.
b Dado ausente para 1 paciente.
Problemas digestivos
Pode causar náuseas, diarreia, prisão de ventre e vômitos. Use medicamentos de suporte e mantenha hidratação.
Oriente pacientes sobre sinais de desidratação como tontura ou desmaio.
Síndrome da lise tumoral
Pode ocorrer em pacientes com alta carga tumoral. Monitore e tome precauções.
Pacientes com problemas hepáticos
A exposição ao medicamento aumenta nesses pacientes. Use doses iniciais reduzidas e monitore toxicidade.
Síndrome de encefalopatia posterior reversível (SEPR)
Relatados casos raros com convulsões, hipertensão e alterações neurológicas. Confirme com exames de imagem.
Suspenda o medicamento se ocorrer. Segurança na retomada é desconhecida.
Câncer, mutações e fertilidade
Estudos de carcinogenicidade não realizados.
Demonstrou potencial para causar danos cromossômicos. Pode afetar fertilidade masculina e feminina.
Toxicidade em animais
Cardiovascular:
Doses elevadas causaram alterações cardíacas graves e morte em estudos com animais.
Uso prolongado:
Sinais de toxicidade incluíram anemia grave, problemas digestivos, neurológicos e hemorragias.
Grupos especiais
Gravidez (Categoria D)
Evite gravidez durante o tratamento.
Estudos em animais mostraram toxicidade reprodutiva. Não existem estudos controlados em gestantes.
Não use durante a gestação sem orientação. Informe imediatamente em caso de suspeita de gravidez.
Amamentação
Não amamente durante o tratamento. Não se sabe se o medicamento passa para o leite.
Dirigir e operar máquinas
Pode causar fadiga, tontura ou visão turva. Evite atividades que exijam atenção se ocorrerem sintomas.
Idosos, crianças e outros grupos
Idosos podem ser mais sensíveis. Segurança em crianças não estabelecida para mieloma múltiplo.
Efeitos colaterais do Bozemyb
Resumo de estudos clínicos com aplicação na veia em mieloma recorrente
A segurança foi avaliada em 3 estudos com dose de 1,3 mg/m2, incluindo 669 pacientes com mieloma refratário ou recorrente.
Tabela 17: Reações adversas em estudos de Fase 2 e 3
N° do estudo
| ||
Sistema/Reação | M34101-039 (N = 331) | M34100- 024/M34100 - 025 |
Sangue e sistema linfático | ||
Plaquetas baixas | 115 (35%) | 97 (43%) |
Anemia | 87 (26%) | 74 (32%) |
Glóbulos brancos baixos | 62 (19%) | 55 (24%) |
a Todos receberam 1,3 mg/m2.
b Inclui desfecho fatal.
c Estudo com pacientes após múltiplas terapias.
d Incluindo todos os termos de neuropatia periférica.
Resumo de estudos com aplicação na veia versus sob a pele em mieloma recorrente
Estudo comparando segurança e eficácia das vias subcutânea (SC) e intravenosa (IV) em 222 pacientes.
Tabela 18: Reações adversas em ≥ 10% dos pacientes

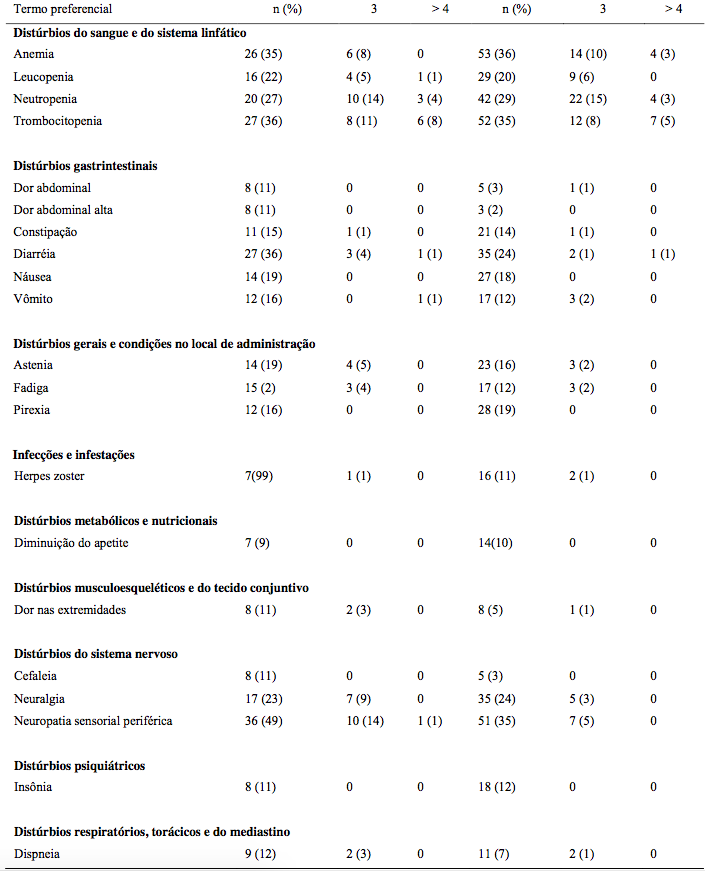
*Graduação conforme critérios NCI-CTCAE.
Tabela 19: Diferenças > 10% na incidência entre vias
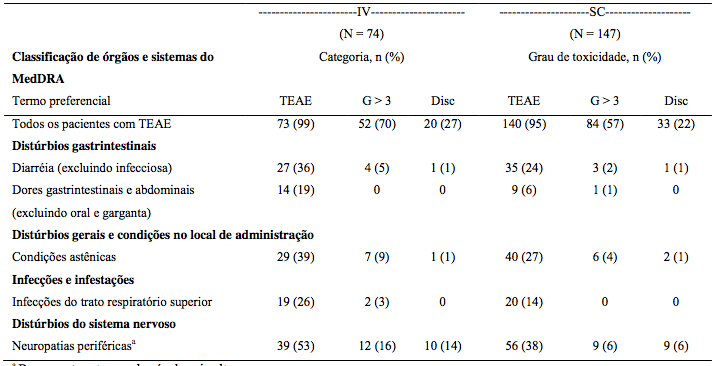
a Termo principal.
TEAE = Evento adverso emergente.
G > 3 = Grau ≥3.
Disc = Descontinuação.
*Graduação conforme NCI-CTCAE.
A via SC apresentou menor incidência de efeitos graves e descontinuações. Reações locais ocorreram em 6% dos pacientes.
Resumo em pacientes não tratados
Tabela abaixo descreve dados de segurança em 340 pacientes tratados com combinação terapêutica.
Tabela 18: Reações adversas em combinação com melfalana e prednisona (≥10%)
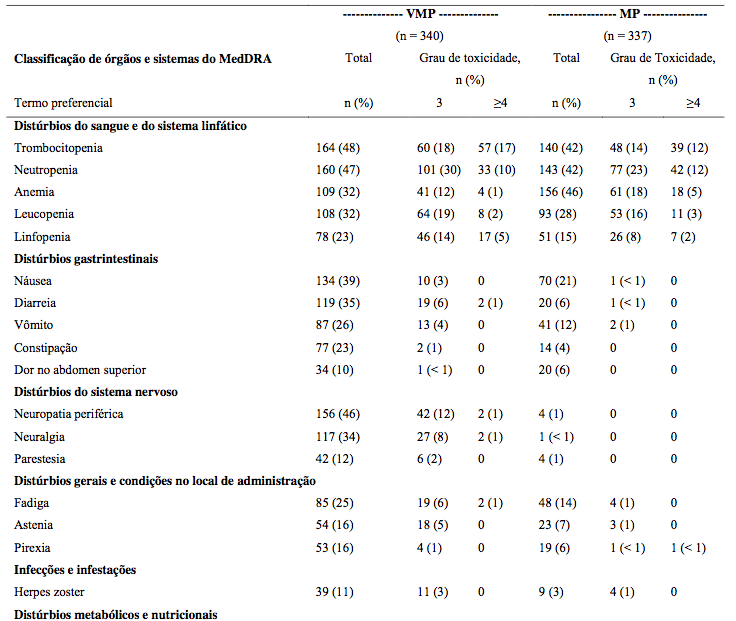
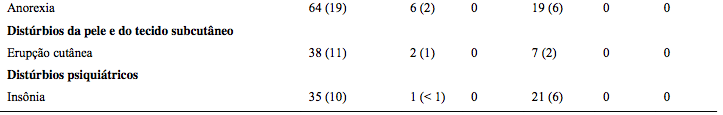
Reativação do herpes zoster
Mais comum com o tratamento combinado (14% vs 4%). Profilaxia antiviral reduziu incidência para 3%.
Tabela 21: Reações adversas durante fase de indução
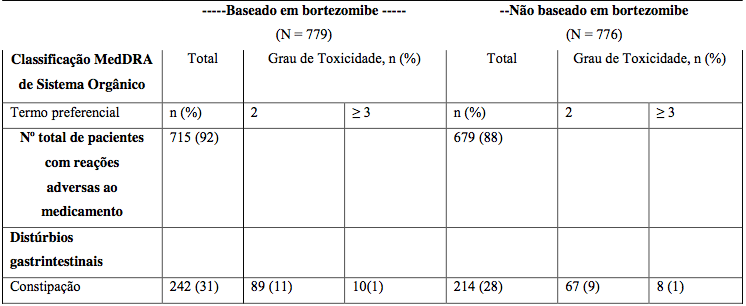
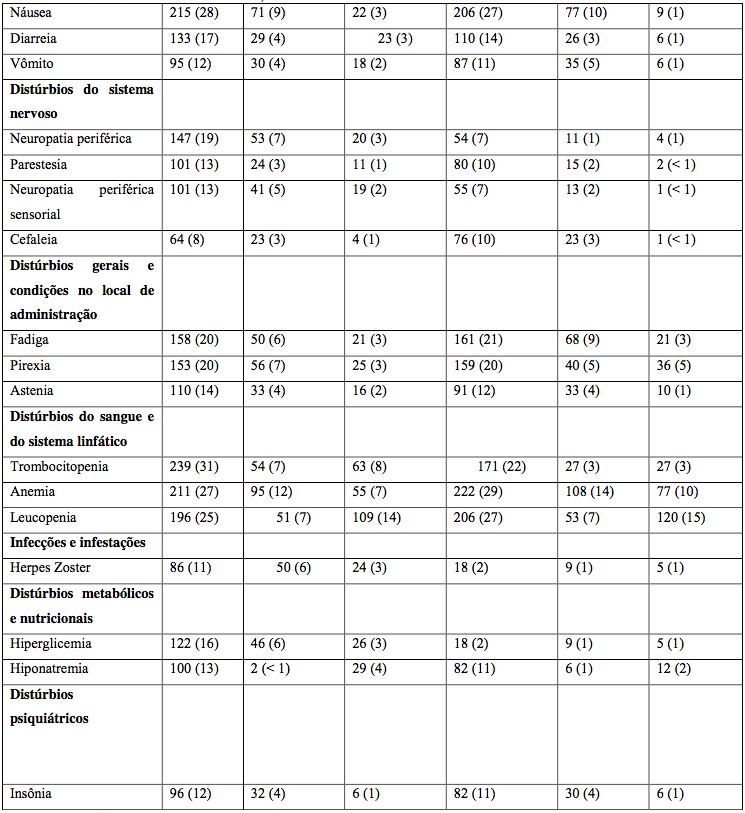 Vc = Bortezomibe.
Vc = Bortezomibe.
Relatos pós-comercialização
Eventos clinicamente significativos não relatados anteriormente:
Incomum (>1/1.000 e ≤1/100):
Digestivo:
Obstrução intestinal.
Raro (> 1/10.000 e ≤ 1/1.000):
Sangue:
Coagulação intravascular disseminada.
Cardíaco:
Bloqueio cardíaco, tamponamento.
Auditivo:
Surdez bilateral,
a: Casos raros de infecção pelo vírus JC com causalidade desconhecida.
Atenção: notifique eventos adversos pelo NOTIVISA ou Vigilância Sanitária.
Superdose de Bozemyb
Estudos em animais mostraram que doses elevadas causam aumento da frequência cardíaca, hipotensão e morte.
Em pacientes, superdose maior que o dobro da recomendada causou hipotensão sintomática e plaquetas baixas com evolução fatal.
Não há antídoto específico. Monitore sinais vitais e forneça suporte para manter pressão arterial.
Em caso de intoxicação, ligue para 0800 722 6001.
Interações com outros medicamentos
Inibe fracamente enzimas do citocromo P450. Cetoconazol (inibidor CYP3A4) aumenta exposição em 35%. Rifampicina (indutor CYP3A4) reduz exposição em 45%.
Não recomendado uso com potentes indutores de CYP3A4 (rifampicina, carbamazepina, erva-de-são-joão).
Omeprazol (inibidor CYP2C19) não altera farmacocinética significativamente.
Pacientes diabéticos podem necessitar ajuste de medicação. Monitore glicemia.
Oriente sobre medicamentos que podem causar neuropatia periférica (amiodarona, isoniazida) ou reduzir pressão.
Interações com exames
Não conhecidas.
Interações com alimentos
Não há relatos até o momento.
Como o Bozemyb funciona?
Resultados de eficácia
Estudo em pacientes não tratados
Estudo Fase 3 comparando combinação terapêutica versus tratamento padrão em 682 pacientes não candidatos a transplante.
Tabela 1: Características iniciais dos pacientes
Característica | Grupo VMP | Grupo MP |
Idade mediana (anos) | 71,0 | 71,0 |
Tabela 2: Resumo de eficácia
Desfecho | VMP | MP |
Tempo até progressão | ||
Mediana (meses) | 20,7 | 15,0 |
Pacientes elegíveis a transplante
Três estudos Fase 3 (1572 pacientes) demonstraram benefícios em sobrevida livre de progressão e taxas de resposta.
Tabela 3: Resultados com tratamento de indução contendo Bortezomibe (Vc)
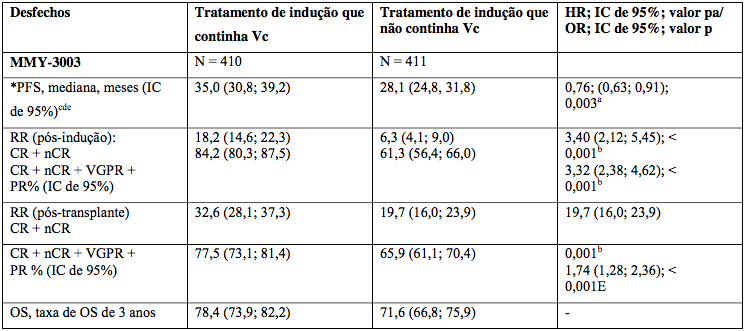
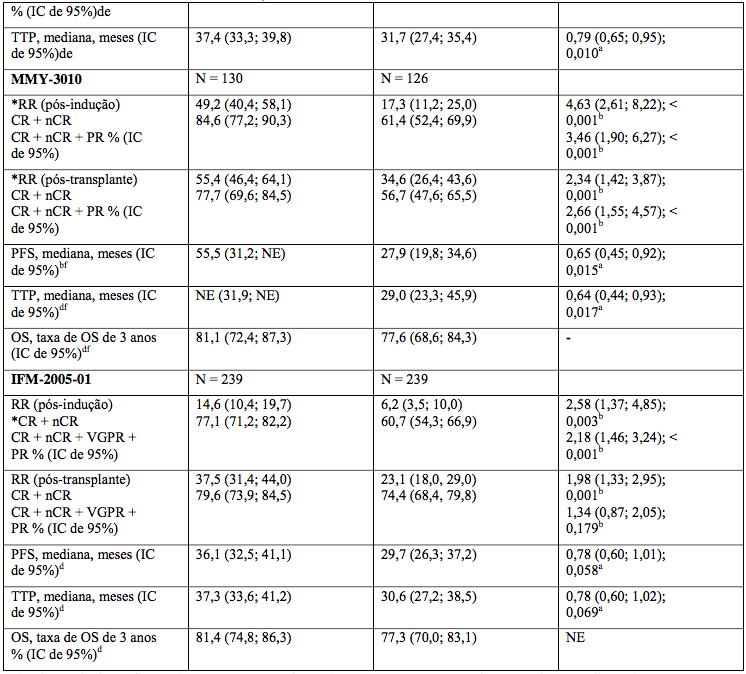
Estudos em mieloma recorrente
Estudo Fase 3 comparando com dexametasona em 669 pacientes. Grupo com Bozemyb apresentou maior taxa de resposta (38% vs 18%) e maior tempo até progressão (6,2 vs 3,5 meses).
Tabela 7: Resumo de eficácia
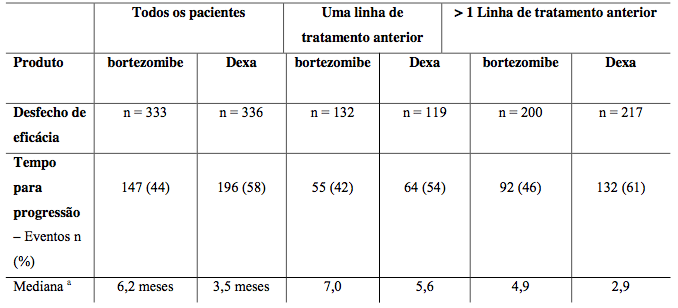
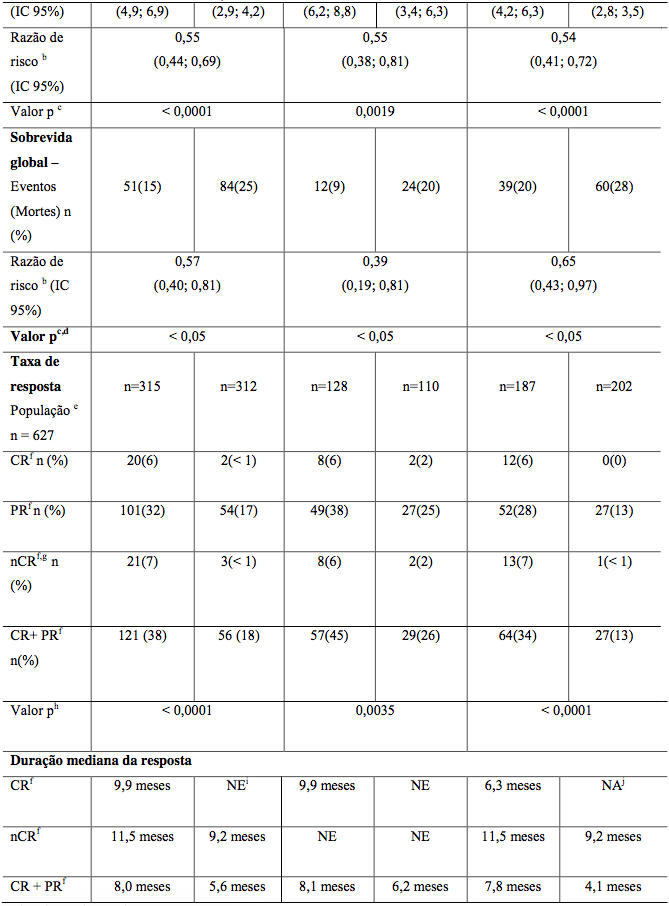
Estudo comparando aplicação na veia versus sob a pele
Estudo mostrou equivalência entre vias subcutânea e intravenosa. Taxa de resposta similar (42% em ambos).
Tabela 9: Resumo de eficácia por via de aplicação
Via Veia (IV) | Via Pele (SC) | |
Taxa resposta (4 ciclos) | 42% | 42% |
Características farmacológicas
Mecanismo de ação
Inibe reversivelmente o proteassoma 26S, interrompendo processos celulares essenciais e levando à morte de células cancerosas.
Farmacocinética
Após dose intravenosa de 1,3 mg/m2, concentração plasmática máxima média de 112 ng/mL. Meia-vida de eliminação entre 40-193 horas.
Exposição sistêmica equivalente entre vias subcutânea e intravenosa. Concentração máxima menor via subcutânea (20,4 vs 223 ng/mL).
Distribuição
Amplamente distribuído nos tecidos. Ligação a proteínas plasmáticas: 83%.
Metabolismo
Metabolizado principalmente por enzimas CYP3A4, CYP2C19 e CYP1A2. Metabólitos inativos.
Eliminação
Vias de eliminação não caracterizadas em humanos.
Grupos especiais
Idade, sexo e raça
Sem diferenças clinicamente relevantes. Depuração em crianças similar à adultos quando ajustada por área corporal.
Problemas hepáticos
Exposição aumentada em 60% em insuficiência moderada/grave. Use doses iniciais reduzidas e monitore.
Problemas renais
Sem alterações significativas na farmacocinética. Administrar após diálise.

 Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.
Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 01 de outubro de 2025.