Como a substância do Aglitil age no corpo?
Resultados de Eficácia
Monoterapia
Três estudos randomizados, duplo-cegos, controlados por placebo com duração de 16 a 26 semanas avaliaram cloridrato de pioglitazona em monoterapia para diabetes tipo II. Estes estudos testaram doses de até 45 mg ou placebo uma vez ao dia em 865 pacientes.
Estudo de variação de dose (Estudo PNFP-001)
Neste estudo de monoterapia de 26 semanas, 408 pacientes com diabetes tipo II foram distribuídos para receber 7,5 mg, 15 mg, 30 mg ou 45 mg de cloridrato de pioglitazona ou placebo uma vez ao dia. Qualquer terapia antidiabética anterior foi interrompida 8 semanas antes do período duplo-cego. As doses de 15 mg, 30 mg e 45 mg de cloridrato de pioglitazona produziram melhorias significativas na HbA1c e glicemia em jejum em comparação com placebo (ver Figura 1, Tabela 1).
Figura 1 mostra a alteração na HbA1c ao longo de 26 semanas.
Figura 1: Alteração média na HbA1c em estudo controlado por placebo de 26 semanas (valores observados) – Estudo PNFP-001
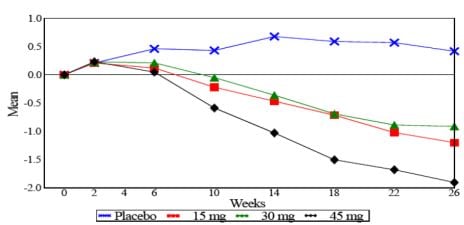
Tabela 1: Parâmetros glicêmicos em 26 semanas de estudo de monoterapia controlado por placebo (Estudo PNFP-001)
| - | Placebo | Cloridrato de Pioglitazona 15 mg/dia | Cloridrato de Pioglitazona 30mg/dia | Cloridrato de Pioglitazona 45mg/dia |
População total | ||||
HbA1C (%) | N = 79 | N = 79 | N = 85 | N = 76 |
Basal (média) | 10,4 | 10,2 | 10,2 | 10,3 |
Mudança do basal (média ajustada*) | 0,7 | -0,3 | -0,3 | -0,9 |
Diferença do placebo (média ajustada*) | - | -1,0† (-1,6, -0,4) | -1,0† (-1,6, -0,4) | -1,6† |
Glicemia de jejum (mg/dL) | N = 79 | N = 79 | N = 84 | N = 77 |
Basal (média) | 268 | 267 | 269 | 276 |
Mudança do basal (média ajustada*) | 9 | -30 | -32 | -56 |
Diferença do placebo (média ajustada*) | - | -39† (-63, -16) | -41† (-64, -18) | -65† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo.
Estudo de titulação de dose (Estudo PNFP-012)
Em estudo controlado por placebo de 24 semanas, 260 pacientes com diabetes tipo II foram distribuídos para grupos de titulação forçada de cloridrato de pioglitazona ou placebo. A terapia antidiabética anterior foi interrompida 6 semanas antes do período duplo-cego.
Em um grupo, pacientes receberam dose inicial de 7,5 mg/dia, aumentada para 15 mg/dia após 4 semanas e para 30 mg/dia após mais 4 semanas (16 semanas restantes). No segundo grupo, iniciaram com 15 mg/dia e foram titulados para 30 mg/dia e 45 mg/dia similarmente.
O tratamento produziu melhoras significativas na HbA1c e glicemia em jejum versus placebo (ver Tabela 2).
Tabela 2: Parâmetros glicêmicos em 24 semanas de estudo de monoterapia controlado por placebo (Estudo PNFP-012)
| - | Placebo | Cloridrato de Pioglitazona 30 mg/dia | Cloridrato de Pioglitazona 45 mg/dia |
População total | |||
HbA1C (%) | N = 83 | N = 85 | N = 85 |
Basal (média) | 10,8 | 10,3 | 10,8 |
Mudança do basal (média ajustada*) | 0,9 | -0,6 | -0,6 |
Diferença do placebo (média ajustada*) | - | -1,5† (-2,0, -1,0) | -1,5† |
Glicemia de jejum (mg/dL) | N = 78 | N = 82 | N = 85 |
Basal (média) | 279 | 268 | 281 |
Mudança do basal (média ajustada*) | 18 | -44 | -50 |
Diferença do placebo (média ajustada*) | - | -62† (-82, -0,41) | -68† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
**Dose final em titulação forçada.
†p ≤ 0,05 vs. placebo.
Estudo de monoterapia de 16 semanas (Estudo PNFP-026)
Neste estudo, 197 pacientes com diabetes tipo II foram distribuídos para 30 mg de cloridrato de pioglitazona ou placebo uma vez ao dia por 16 semanas. A terapia anterior foi interrompida 6 semanas antes. A dose de 30 mg produziu melhorias significativas na HbA1c e glicemia em jejum versus placebo (Tabela 3).
Tabela 3: Parâmetros glicêmicos em 16 semanas de estudo de monoterapia controlado por placebo (Estudo PNFP-012)
| - | Placebo | Cloridrato de Pioglitazona 30 mg/dia* |
População total | ||
HbA1C (%) | N = 93 | N = 100 |
Basal (média) | 10,3 | 10,5 |
Mudança do basal (média ajustada*) | 0,8 | -0,6 |
Diferença do placebo (média ajustada*) | - | 1,4† |
Glicemia de jejum (mg/dL) | N = 91 | N = 99 |
Basal (média) | 270 | 273 |
Mudança do basal (média ajustada*) | 8 | -50 |
Diferença do placebo (média ajustada*) | - | -58† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo.
Terapia Combinada
Três estudos clínicos de 16 semanas, duplo-cegos randomizados, controlados por placebo avaliaram cloridrato de pioglitazona (15 mg e/ou 30 mg) em pacientes com diabetes tipo II com controle inadequado (HbA1c ≥ 8%) apesar de terapia com sulfonilureia, metformina ou insulina. Três estudos de 24 semanas avaliaram cloridrato de pioglitazona 30 mg versus 45 mg nas mesmas condições. O tratamento anterior podia ser monoterapia ou combinação.
Estudos de associação a sulfonilureias
Dois estudos clínicos avaliaram cloridrato de pioglitazona com sulfonilureia. Pacientes usavam sulfonilureia em qualquer dose, isolada ou combinada. Outros antidiabéticos foram suspensos pelo menos três semanas antes.
Estudo de 16 semanas com associação a sulfonilureia (Estudo PNFP-010)
Neste estudo, 560 pacientes receberam 15 mg ou 30 mg de cloridrato de pioglitazona ou placebo uma vez ao dia por 16 semanas, além da sulfonilureia. O tratamento combinado produziu melhoras significativas na HbA1c e glicemia em jejum versus placebo + sulfonilureia (Tabela 4).
Tabela 4: Parâmetros glicêmicos em 16 semanas de estudo controlado por placebo com sulfonilureia (Estudo PNFP-010)
| - | Placebo + Sulfonilureia | Cloridrato de Pioglitazona 15 mg + sulfonilureia | Cloridrato de Pioglitazona 30 mg + sulfonilureia |
População total | |||
HbA1C (%) | N = 181 | N = 176 | N = 182 |
Basal (média) | 9,9 | 10,0 | 9,9 |
Mudança do basal (média ajustada*) | 0,1 | -0,8 | -1,2 |
Diferença do placebo + sulfonilureia (média ajustada*) | - | -0,9† (-1,2, -0,6) | -1,3† |
Glicemia de jejum (mg/dL) | N = 182 | N = 179 | N = 186 |
Basal (média) | 236 | 247 | 239 |
Mudança do basal (média ajustada*) | 6 | -34 | -52 |
Diferença do placebo + sulfonilureia (média ajustada*) | - | -39† (-52, -27) | -58† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + sulfonilureia.
Estudo de 24 semanas com associação à sulfonilureia (Estudo PNFP-341)
Neste estudo, 702 pacientes receberam 30 mg ou 45 mg de cloridrato de pioglitazona uma vez ao dia por 24 semanas além da sulfonilureia. A redução média de HbA1c na 24ª semana foi de 1,6% para 30 mg e 1,7% para 45 mg (ver Tabela 5). A redução média de glicemia em jejum foi de 52 mg/dL para 30 mg e 56 mg/dL para 45 mg.
O efeito terapêutico foi observado independentemente da dose de sulfonilureia.
Tabela 5: Parâmetros glicêmicos em 24 semanas de estudo controlado por placebo com sulfonilureia (Estudo PNFP-341)
| - | Cloridrato de Pioglitazona 30 mg + sulfonilureia | Cloridrato de Pioglitazona 45 mg + sulfonilureia |
População total | ||
HbA1C (%) | N = 340 | N = 332 |
Basal (média) | 9,8 | 9,9 |
Mudança do basal (média ajustada*) | -1,6 | -1,7 |
Diferença de Cloridrato de Pioglitazona 30 mg + sulfonilureia (média ajustada*) 95% IC | - | -0,1 |
Glicemia de jejum (mg/dL) | N = 338 | N = 329 |
Basal (média) | 214 | 217 |
Mudança do basal (média ajustada*) | -52 | -56 |
Diferença de Cloridrato de Pioglitazona 30 mg + sulfonilureia (média ajustada*) 95% IC | - | -5 |
95% IC = Intervalo de confiança 95%.
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
Estudos de associação à metformina
Dois estudos clínicos avaliaram cloridrato de pioglitazona com metformina. Pacientes usavam metformina em qualquer dose, isolada ou combinada. Outros antidiabéticos foram suspensos pelo menos três semanas antes.
Estudo de 16 semanas com associação à metformina (Estudo PNFP-027)
Neste estudo, 328 pacientes receberam 30 mg de cloridrato de pioglitazona ou placebo uma vez ao dia por 16 semanas além da metformina. O tratamento combinado produziu melhoras significativas na HbA1c e glicemia em jejum versus placebo + metformina (ver Tabela 6).
Tabela 6: Parâmetros glicêmicos em 16 semanas de estudo controlado por placebo com metformina (Estudo PNFP-027)
| - | Placebo + metformina | Cloridrato de Pioglitazona 30 mg + metformina |
População total | ||
HbA1C (%) | N = 153 | N = 161 |
Basal (média) | 9,8 | 9,9 |
Mudança do basal (média ajustada*) | 0,2 | -0,6 |
Diferença do placebo + metformina (média ajustada*) | - | -0,8† |
Glicemia de jejum (mg/dL) | N = 157 | N = 165 |
Basal (média) | 260 | 254 |
Mudança do basal (média ajustada*) | -5 | -43 |
Diferença do placebo + metformina (média ajustada*) | - | -38† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + metformina.
Estudo de 24 semanas com associação à metformina (Estudo PNFP-342)
Neste estudo, 827 pacientes receberam 30 mg ou 45 mg de cloridrato de pioglitazona uma vez ao dia por 24 semanas além da metformina. A redução média de HbA1c na 24ª semana foi de 0,8% para 30 mg e 1,0% para 45 mg (ver Tabela 7). A redução média de glicemia em jejum foi de 38 mg/dL para 30 mg e 51 mg/dL para 45 mg.
Tabela 7: Parâmetros glicêmicos em 24 semanas de estudo controlado por placebo com metformina (Estudo PNFP-342)
| - | Cloridrato de Pioglitazona 30 mg + metformina | Cloridrato de Pioglitazona 45 mg + metformina |
População total | ||
HbA1C (%) | N = 400 | N = 398 |
Basal (média) | 9,9 | 9,8 |
Mudança do basal (média ajustada*) | -0,8 | -1,0 |
Diferença de Cloridrato de Pioglitazona 30 mg + metformina (média ajustada*) 95% IC | - | -0,2 |
Glicemia de jejum (mg/dL) | N = 398 | N = 399 |
Basal (média) | 233 | 232 |
Mudança do basal (média ajustada*) | -38 | -51 |
Diferença de Cloridrato de Pioglitazona 30 mg + metformina (média ajustada*) 95% IC | - | -12† |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Cloridrato de Pioglitazona 30 mg, um comprimido, diariamente + metformina.
O efeito terapêutico foi observado independentemente da dose de metformina.
Estudos de associação à insulina
Dois estudos clínicos avaliaram cloridrato de pioglitazona com insulina. Pacientes usavam insulina isoladamente ou combinada. Outros antidiabéticos foram suspensos antes do início.
Estudo de associação à insulina (Estudo PNFP-014)
Neste estudo, 566 pacientes receberam 15 mg ou 30 mg de cloridrato de pioglitazona ou placebo uma vez ao dia por 16 semanas além da insulina. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum versus placebo + insulina (ver Tabela 8). A dose diária média inicial de insulina foi aproximadamente 70 unidades.
A maioria (75% do total) não teve alteração na dose diária de insulina. A alteração média basal na dose diária foi -3 unidades com 15 mg e -8 unidades com 30 mg de cloridrato de pioglitazona, versus -1 unidade com placebo.
Tabela 8: Parâmetros glicêmicos em 16 semanas de estudo controlado por placebo com insulina (Estudo PNFP-014)
| - | Placebo + insulina | Cloridrato de Pioglitazona 15 mg + insulina | Cloridrato de Pioglitazona 30 mg + insulina |
População total | |||
HbA1C (%) | N = 177 | N = 177 | N = 185 |
Basal (média) | 9,8 | 9,8 | 9,8 |
Mudança do basal (média ajustada*) | -0,3 | -1,0 | -1,3 |
Diferença do placebo + insulina (média ajustada*) Intervalo de Confiança 95% | - | -0,7† (-1,0, -0,5) | -1,0† |
Glicemia de jejum (mg/dL) | N = 179 | N = 183 | N = 184 |
Basal (média) | 221 | 222 | 229 |
Mudança do basal (média ajustada*) | 1 | -35 | -48 |
Diferença do placebo + insulina (média ajustada*) Intervalo de Confiança 95% | - | -35† | -49† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + insulina.
Estudo de 24 semanas com associação à insulina (Estudo PNFP-343)
Neste estudo, 690 pacientes usando média de 60 unidades de insulina/dia receberam 30 mg ou 45 mg de cloridrato de pioglitazona uma vez ao dia por 24 semanas além da insulina. A redução média de HbA1c na 24ª semana foi de 1,2% para 30 mg e 1,5% para 45 mg. A redução média de glicemia em jejum foi de 32 mg/dL para 30 mg e 46 mg/dL para 45 mg (ver Tabela 9). A maioria (55% do total) não alterou a dose diária de insulina. A alteração média basal na dose diária foi -5 unidades com 30 mg e -8 unidades com 45 mg.
Tabela 9: Parâmetros glicêmicos em 24 semanas de estudo controlado por placebo com insulina (Estudo PNFP-343)
| - | Cloridrato de Pioglitazona 30 mg + insulina | Cloridrato de Pioglitazona 45 mg + insulina |
População total | ||
HbA1C (%) | N = 328 | N = 328 |
Basal (média) | 9,9 | 9,7 |
Mudança do basal (média ajustada*) | -1,2 | -1,5 |
Diferença de Cloridrato de Pioglitazona 30 mg + insulina (média ajustada*) 95% IC | - | -0,3† |
Glicemia de jejum (mg/dL) | N = 325 | N = 327 |
Basal (média) | 202 | 199 |
Mudança do basal (média ajustada*) | -32 | -46 |
Diferença de Cloridrato de Pioglitazona 30 mg + insulina (média ajustada*) 95% IC | - | -14† |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Cloridrato de Pioglitazona 30 mg, um comprimido, diariamente + insulina.
O efeito terapêutico foi observado independentemente da dose de insulina.
Em vários estudos, incluindo comparativos duplo-cegos, com 15 mg, 30 mg ou 45 mg de cloridrato de pioglitazona uma vez ao dia, a taxa de melhoria ("melhora moderada" ou superior) em 821 pacientes foi 50,8%.
Em estudos de longo prazo (28-48 semanas ou mais), o controle glicêmico estável foi alcançado, com reduções mantidas na glicemia de jejum e HbA1c sem perda de efeito terapêutico.
Resultados de estudos comparativos duplo-cegos:
Diabetes tipo II tratados apenas com dieta/exercício
- Com 30 mg/dia por 12 semanas, HbA1c diminuiu 1,08 ± 1,47% (média ± DP; 63 pacientes).
Diabetes tipo II tratados com sulfonilureias + dieta/exercício
- Com 30 mg/dia por 12 semanas, HbA1c diminuiu 1,24 ± 1,33% (56 pacientes).
Diabetes tipo II tratados com inibidores de alfa-glicosidase + dieta/exercício
- Com 30 mg/dia por 16 semanas, HbA1c diminuiu 0,91 ± 0,89% (55 pacientes).
Diabetes tipo II tratados com biguanidas + dieta/exercício
- Com 15 mg/dia por 12 semanas seguido de 30 mg/dia por 16 semanas, HbA1c diminuiu 0,67 ± 0,80% (83 pacientes).
Diabetes tipo II tratados com insulina + dieta/exercício
- Com 30 mg/dia por 16 semanas, HbA1c diminuiu 1,22 ± 1,11% (45 pacientes).
Em estudo controlado por placebo, pacientes com controle glicêmico inadequado após três meses de otimização de insulina receberam cloridrato de pioglitazona ou placebo por 12 meses. O grupo com cloridrato de pioglitazona teve redução média de HbA1c de 0,45% versus insulina isolada e redução da dose de insulina.
Análise HOMA mostra que cloridrato de pioglitazona melhora a função das células beta e aumenta a sensibilidade à insulina, efeito mantido em estudos de dois anos.
Em estudos de um ano, cloridrato de pioglitazona promoveu redução consistente e significativa na relação albumina/creatinina versus basal.
Em estudo de 18 semanas, cloridrato de pioglitazona (monoterapia 45 mg vs. placebo) foi associado a ganho de peso significativo, redução de gordura visceral e aumento de gordura extra-abdominal, acompanhados de melhora na sensibilidade à insulina. Na maioria dos estudos, observou-se redução de triglicerídeos totais e ácidos graxos livres, aumento de HDL-colesterol e leve aumento não clinicamente significativo de LDL-colesterol.
Em estudos de até dois anos, cloridrato de pioglitazona reduziu triglicerídeos plasmáticos totais e ácidos graxos livres, aumentou HDL-colesterol versus placebo, metformina ou gliclazida.
Cloridrato de pioglitazona não causou elevações estatisticamente significativas em LDL-colesterol versus placebo, enquanto reduções ocorreram com metformina e gliclazida. Em estudo de 20 semanas, além de reduzir triglicerídeos em jejum, cloridrato de pioglitazona reduziu hipertrigliceridemia pós-prandial, efeitos independentes do controle glicêmico e significativamente diferentes da glibenclamida.
População pediátrica
A EMA dispensou estudos pediátricos para diabetes tipo II.
Referências Bibliográficas
Egan JW, Mathisen AL, Pioglitazona 012 Study Group. The Effect of Pioglitazone on Glucose Control and Lipid Profile in Patients with Type 2 Diabetes. Diabetes. 2000;49(Suppl.1):A105.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Tiazolidinodionas.
Código ATC: A10BG03.
Mecanismo de ação
Cloridrato de pioglitazona é uma tiazolidinodiona que requer insulina para ação. Reduz resistência insulínica periférica e hepática, aumentando captação de glicose dependente de insulina e reduzindo produção hepática de glicose. Não é secretagogo de insulina.
É agonista do receptor γ de peroxissomo proliferador-ativado (PPARγ). Receptores PPAR estão presentes em tecidos importantes para ação insulínica (adiposo, muscular esquelético, hepático). Ativação modula transcrição de genes responsivos à insulina envolvidos no controle de glicose e lipídios.
Em modelos animais diabéticos, reduz hiperglicemia, hiperinsulinemia e hipertrigliceridemia característicos de resistência insulínica. Alterações metabólicas aumentam responsividade tecidual e são observadas em vários modelos.
Como aumenta efeitos da insulina circulante (reduzindo resistência), não reduz glicemia em modelos sem insulina endógena.
Segurança cardiovascular
Em estudo com insulina, placebo-controlado, duplo-cego (566 pacientes), insuficiência cardíaca ocorreu em 1,1% com cloridrato de pioglitazona 15 mg + insulina e 1,1% com 30 mg + insulina versus 0% com insulina isolada. Em outro estudo, 0,3% com 30 mg e 0,9% com 45 mg relataram insuficiência cardíaca grave. Nenhum fator preditivo específico foi identificado.
Estudo pós-comercialização comparou cloridrato de pioglitazona (n = 262) e glibenclamida (n = 256) em diabéticos com insuficiência cardíaca NYHA classe II/III e fração de ejeção < 40%. Hospitalização por insuficiência cardíaca ocorreu em 9,9% com cloridrato de pioglitazona versus 4,7% com glibenclamida. Sem diferença na mortalidade cardiovascular.
No estudo PROactive (estudo prospectivo de eventos macrovasculares), 5.238 pacientes com diabetes tipo II e história de doença macrovascular receberam cloridrato de pioglitazona (n = 2.605) titulado até 45 mg/dia ou placebo (n = 2.633) além de tratamento padrão. Quase todos (95%) usavam medicamentos cardiovasculares. Idade média 61,8 anos, duração média do diabetes 9,5 anos, HbA1c média 8,1%. Acompanhamento médio 34,5 meses. Desfecho primário foi tempo para primeiro evento cardiovascular composto (mortalidade por todas as causas, infarto miocárdico não fatal incluindo silencioso, AVC, síndrome coronariana aguda, intervenção cardíaca, amputação de perna acima do tornozelo, revascularização de perna).
514 (19,7%) com cloridrato de pioglitazona e 572 (21,7%) com placebo tiveram pelo menos um evento do desfecho primário composto (hazard ratio 0,90; IC 95%: 0,80, 1,02, p= 0,10). Sem diferença estatística, mas sem aumento na mortalidade ou número total de eventos macrovasculares com cloridrato de pioglitazona (ver tabela 10). Porcentagem com insuficiência cardíaca grave foi maior com cloridrato de pioglitazona (5,7%, n = 149) versus placebo (4,1%, n = 108). Mortalidade após insuficiência cardíaca grave foi 1,5% (n = 40) com cloridrato de pioglitazona e 1,4% (n = 37) com placebo. Em pacientes usando insulina no início, insuficiência cardíaca grave ocorreu em 6,3% (n = 54/864) com cloridrato de pioglitazona e 5,2% (n = 47/896) com placebo. Com sulfonilureia, 5,8% (n = 94/1.624) com cloridrato de pioglitazona e 4,4% (n = 71/1.626) com placebo.
Tabela 10: PROactive: Número de Eventos Primários e Totais para componentes do desfecho cardiovascular composto
Eventos | Placebo | Cloridrato de Pioglitazona | ||
Cardiovasculares | N = 2633 | N = 2605 | ||
| - | Eventos primários n (%) | Eventos totais n | Eventos primários n (%) | Eventos totais n |
Qualquer Evento | 572 (21,7) | 900 | 514 (19,7) | 803 |
Mortalidade de todas as causas | 122 (4,6) | 186 | 110 (4,2) | 177 |
Infarto miocardial nãofatal (IM) | 118 (4,5) | 157 | 105 (4,0) | 131 |
Derrame | 96 (3,6) | 119 | 76 (2,9) | 92 |
Síndrome coronariana agud | 63 (2,4) | 78 | 42 (1,6) | 65 |
Intervenção cardíaca | 101 (3,8) | 240 | 101 (3,9) | 195 |
Amputação extensiva da perna | 15 (0,6) | 28 | 9 (0,3) | 28 |
Revascularização da perna | 57 (2,2) | 92 | 71 (2,7) | 115 |
CRM = cirurgia de revascularização miocárdia; IP = intervenção percutânea.
Farmacocinética
Estudos demonstram que cloridrato de pioglitazona melhora sensibilidade insulínica em pacientes resistentes. Melhora responsividade celular à insulina, aumenta captação de glicose dependente de insulina e sensibilidade hepática. Em diabetes tipo II, reduz glicemia plasmática, insulinemia e HbA1c. Em estudos controlados, teve efeito aditivo sobre controle glicêmico quando combinado com sulfonilureia, metformina ou insulina.
Pacientes com anormalidades lipídicas incluídos. Geralmente, tratamento reduziu triglicerídeos séricos, aumentou HDL-colesterol, sem alterações consistentes em LDL e colesterol total. Sem evidência conclusiva de benefício macrovascular.
Propriedades farmacocinéticas
Absorção
Após administração oral, pico de concentração em 2 horas. Alimentos retardam Tmáx para 3-4 horas sem alterar ASC (Estudo PNFP-036). Biodisponibilidade absoluta >80% (Estudo EC-241).
Após dose única diária, concentrações séricas em estado estacionário de cloridrato de pioglitazona e metabólitos ativos M-III (derivado ceto) e M-IV (derivado hidroxila) atingidas em 7 dias. Em estado estacionário, M-III e M-IV atingiram concentrações iguais ou maiores que cloridrato de pioglitazona. Cloridrato de pioglitazona compreendeu 30-50% do pico total e 20-25% da ASC total. Sem acúmulo (Estudo CPH-002).
Cmáx, ASC e Cmín aumentaram proporcionalmente com doses de 15 mg e 30 mg/dia.
Distribuição
Volume aparente de distribuição médio após dose única ~0,25-0,63 L/kg. Liga-se extensamente a proteínas séricas humanas (>99%), principalmente albumina. Metabólitos M-III e M-IV também ligam-se extensamente a albumina (>98%) (Estudos A-35-00384, A-35-00385, A-35-00802, A-35-01202).
Metabolismo
Extensivamente metabolizado por hidroxilação e oxidação. Metabólitos parcialmente convertidos em glicuronídeos ou sulfatos. Múltiplas isoformas CYP envolvidas (principalmente CYP2C8, menor contribuição CYP3A4, outras incluindo CYP1A1 extra-hepática). Três de seis metabólitos ativos (M-II, M-III, M-IV).
Considerando concentrações e ligação proteica, cloridrato de pioglitazona e M-III contribuem igualmente para eficácia. M-IV contribui ~3 vezes mais que cloridrato de pioglitazona; contribuição de M-II mínima.
Estudos in vivo com genfibrozila (inibidor forte de CYP2C8) mostraram que cloridrato de pioglitazona é substrato de CYP2C8.
Estudos in vivo não demonstraram inibição de subtipos CYP. Sem indução de CYP1A, CYP2C8/09 e CYP3A4 principais.
Razões cortisol/6β-hidrocortisol urinárias mostraram que não é indutor forte de CYP3A4.
Estudos de interação: sem efeito relevante na farmacocinética/farmacodinâmica de digoxina, varfarina, femprocumona, metformina. Genfibrozila aumenta e rifampicina reduz concentração plasmática de cloridrato de pioglitazona.
Excreção e eliminação
Após administração oral, ~15-30% recuperado na urina. Eliminação renal insignificante; principalmente excretado como metabólitos e conjugados.
Maior parte da dose oral excretada na bile inalterada ou como metabólitos, eliminada nas fezes. Meia-vida sérica média de cloridrato de pioglitazona e metabólitos (M-III e M-IV) 3-7 h e 16-24 h, respectivamente. Depuração aparente 5-7 L/h.
Após dose oral radiomarcada, recuperação principalmente fecal (55%) e urinária (45%). Meia-vida de eliminação plasmática média de cloridrato de pioglitazona inalterada 5-6 h; metabólitos ativos totais 16-23 h.
Populações especiais
Insuficiência renal
Meia-vida sérica inalterada em insuficiência renal moderada (clearance creatinina 30-50 mL/min) a grave (<30 mL/min) versus função normal. Sem necessidade de ajuste de dose (Estudo EC-230).
Insuficiência hepática
Pacientes com função hepática insuficiente (Child-Turcotte-Pugh B/C) apresentam ~45% redução no pico médio de cloridrato de pioglitazona e total, sem alterações na ASC. Sem necessidade de ajuste de dose.
Relatos pós-comercialização de insuficiência hepática; estudos geralmente excluíram pacientes com TGP >2,5 vezes limite superior. Usar com cautela em doença hepática (Estudo PNFP-007).
Pacientes geriátricos
Em idosos saudáveis, picos de concentração sérica não diferem significativamente, mas ASC ~21% maior versus jovens. Meia-vida terminal média mais longa (~10 h versus ~7 h). Mudanças não clinicamente relevantes (Estudo PNFP-025).
Pacientes pediátricos
Segurança e eficácia não estabelecidas. Não recomendado.
Gênero
Mulheres apresentam Cmáx e ASC 20-60% maiores que homens (Estudo PNFP-025). Em estudos, reduções de HbA1c geralmente maiores em mulheres (diferença média 0,5%). Sem ajuste de dose baseado apenas em gênero.
Etnia
Dados indisponíveis.
Interações entre fármacos
Tabela 11: Efeitos da coadministração de cloridrato de pioglitazona na exposição sistêmica a outros fármacos
| - | Fármaco coadministrado | ||||
Dose de cloridrato de pioglitazona (mg) | Nome e regime de dose | Alteração na ASC† | Alteração no Cmáx† | ||
45mg (N = 12) Estudo EC-221 | Varfarina‡ | ||||
Dose diária, seguida de dose de manutenção baseada nos valores de TP e INR Valores Quick = 35 ± 5% | R-varfarina | ↓3% | R-varfarina | ↓2% | |
S-varfarina | ↓1% | S-varfarina | ↑1% | ||
45 mg (N = 12) Estudo EC-222 | Digoxina | ||||
0,200mg duas vezes ao dia (dose de carga), seguida de 0,250mg diariamente (dose de manutenção, 7 dias) | ↓15% | ↓17% | |||
45mg diariamente por 21 dias (N = 35) Study OPI - 517 | Contraceptivo oral | ||||
[Etinilestradiol (EE) 0,035mg somando a Noretindrona (NE) 1mg] por 21 dias | EE | ↓11% | EE | ↓13% | |
NE | ↓3% | NE | ↓7% | ||
45 mg (N = 23) Study PNFP037 | Fexofenadina | ||||
60mg duas vezes ao dia, por 7 dias | ↓30% | ↑37% | |||
45 mg (N = 14) | Glipizida | ||||
5mg diariamente por 7 dias | ↓3% | ↓8% | |||
45 mg diariamente por 8 dias (N = 16) Estudo EC-223 | Metformina | ||||
| 1000 mg dose única no Dia 8 | ↓3% | ↓5% | |||
45 mg (N = 21) Estudo PNFP-345 | Midazolam | ||||
7,5mg dose única no Dia 15 | ↓26% | ↓26% | |||
45 mg (N = 24) Estudo PNFP-038 | Ranitidina | ||||
| 150 mg duas vezes ao dia por 7 dias | ↑1% | ↓1% | |||
45 mg diariamente por 4 dias (N = 24) Estudo PNFP-040 | Nifedipina liberação modificada | ||||
30 mg diariamente por 4 dias | ↓13% | ↓17% | |||
45 mg (n = 25) Estudo PNFP-039 | Atorvastatina Cálcica | ||||
| 80 mg diariamente por 7 dias | ↓14% | ↓23% | |||
45 mg (N = 22) Estudo OPI-510 | Teofilina | ||||
| 400 mg duas vezes por dia por 7 dias | ↑2% | ↑5% | |||
*Diariamente por 7 dias salvo disposição ao contrário.
† % de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam aumento ou redução da exposição.
‡Sem efeito clínico significante no tempo de protrombina.
Meia-vida aumentou de 8,3h para 22,7h com genfibrozila.
Tabela 12: Efeitos da coadministração na exposição sistêmica ao cloridrato de pioglitazona
Fármaco coadministrado e regime de dose | Cloridrato de Pioglitazona | ||
| Regime de dose (mg)* | Alteração na ASC† | Alteração no Cmáx† | |
Genfibrozila 600mg duas vezes ao dia por 2 dias (N = 12) Jaakota at al 2005 | 15 mg dose única | ↑3,2 vezes | ↑6% |
Cetoconazol 200mg duas vezes ao dia por 7 dias (N = 28) Study OPI - 517 | 45 mg | ↑34% | ↑14% |
Rifampicina 600mg diariamente por 5 dias (N = 10) Jaakota et al 2005 | 30 mg dose única | ↓54% | ↓5% |
Fexofenadina 60mg duas vezes por dia por 7 dias (N = 23) Study PNFP-037 | 45 mg | ↑1% | 0% |
Ranitidina 150mg duas vezes por dia por 4 dias (N = 23) Study PNFP-038 | 45 mg | ↓13% | ↓16% |
Nifedipina liberação modificada 30 mg diariamente por 7 dias (N = 23) Study PNFP-40 | 45 mg | ↑5% | ↑4% |
Atorvastatina Ca 80 mg diariamente por 7 dias (N = 24) Study PNFP-039 | 45 mg | ↓24% | ↓31% |
Teofilina 400mg duas vezes por dia por 7 dias (N = 22) Study OPI-510 | 45 mg | ↓4% | ↓2% |
*Diariamente por 7 dias salvo disposição ao contrário.
Razão média (com/sem fármaco coadministrado e sem alteração = 1 vez);
% de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam aumento ou redução da exposição.
Dados de segurança pré-clínica
Segurança farmacológica
Estudos de segurança não mostraram efeitos adversos significativos nos sistemas cardiovascular, respiratório, nervoso central, nervoso autônomo ou gastrointestinal.
Mutagenicidade, carcinogenicidade
Sem potencial genotóxico em ensaios in vivo e in vitro. Aumento de incidência de hiperplasia e tumores de bexiga em ratos tratados por até 2 anos.
Estudo mecanístico posterior em ratos avaliou efeito da acidificação urinária na formação de cristais. Embora alterações proliferativas persistissem, incidência de tumores reduziu com dieta acidificante.
Sem resposta tumorigênica em ratos de ambos os gêneros. Sem hiperplasia de bexiga em cães ou macacos tratados por até 12 meses.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)