Como o Actos age no organismo?
Resultados de Eficácia
Monoterapia
Três estudos com duração de 16 a 26 semanas avaliaram Cloridrato de Pioglitazona em monoterapia em pacientes com diabetes tipo 2. Esses estudos avaliaram doses de até 45 mg ou placebo uma vez ao dia em 865 pacientes.
Estudo de variação de dose (Estudo PNFP-001)
Em estudo de monoterapia de 26 semanas, 408 pacientes com diabetes tipo 2 receberam 7,5 mg, 15 mg, 30 mg ou 45 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia. O tratamento anterior foi interrompido 8 semanas antes. Doses de 15 mg, 30 mg e 45 mg produziram melhorias significativas na HbA1c e glicemia em jejum comparadas ao placebo.
Figura 1 mostra a alteração na HbA1c ao longo de 26 semanas.
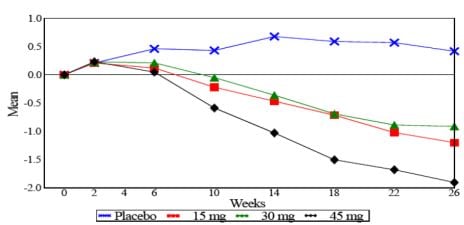
Tabela 1: Parâmetros glicêmicos em 26 semanas (Estudo PNFP-001)
| - | Placebo | Cloridrato de Pioglitazona 15 mg/dia | Cloridrato de Pioglitazona 30mg/dia | Cloridrato de Pioglitazona 45mg/dia |
População total | ||||
HbA1C (%) | N = 79 | N = 79 | N = 85 | N = 76 |
Basal (média) | 10,4 | 10,2 | 10,2 | 10,3 |
Mudança do basal (média ajustada*) | 0,7 | -0,3 | -0,3 | -0,9 |
Diferença do placebo (média ajustada*) | - | -1,0† (-1,6, -0,4) | -1,0† (-1,6, -0,4) | -1,6† |
Glicemia de jejum (mg/dL) | N = 79 | N = 79 | N = 84 | N = 77 |
Basal (média) | 268 | 267 | 269 | 276 |
Mudança do basal (média ajustada*) | 9 | -30 | -32 | -56 |
Diferença do placebo (média ajustada*) | - | -39† (-63, -16) | -41† (-64, -18) | -65† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo.
Estudo de titulação de dose (Estudo PNFP-012)
Em estudo de monoterapia controlado por placebo de 24 semanas, 260 pacientes receberam doses tituladas de Cloridrato de Pioglitazona ou placebo. O tratamento anterior foi interrompido 6 semanas antes.
Em um grupo, pacientes receberam dose inicial de 7,5 mg/dia, aumentada para 15 mg/dia após 4 semanas, e para 30 mg/dia após mais 4 semanas. No outro grupo, iniciaram com 15 mg/dia e foram titulados para 30 mg/dia e 45 mg/dia.
O tratamento produziu melhorias significativas na HbA1c e glicemia em jejum comparadas ao placebo (Tabela 2).
Tabela 2: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-012)
| - | Placebo | Cloridrato de Pioglitazona 30 mg/dia* | Cloridrato de Pioglitazona 45 mg/dia* |
População total | |||
HbA1C (%) | N = 83 | N = 85 | N = 85 |
Basal (média) | 10,8 | 10,3 | 10,8 |
Mudança do basal (média ajustada*) | 0,9 | -0,6 | -0,6 |
Diferença do placebo (média ajustada*) | - | -1,5† (-2,0, -1,0) | -1,5† |
Glicemia de jejum (mg/dL) | N = 78 | N = 82 | N = 85 |
Basal (média) | 279 | 268 | 281 |
Mudança do basal (média ajustada*) | 18 | -44 | -50 |
Diferença do placebo (média ajustada*) | - | -62† (-82, -0,41) | -68† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
**Dose final em titulação forçada.
†p ≤ 0,05 vs. placebo.
Estudo de monoterapia de 16 semanas (Estudo PNFP-026)
Em estudo de 16 semanas, 197 pacientes receberam 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia. O tratamento anterior foi interrompido 6 semanas antes. A dose de 30 mg produziu melhorias significativas na HbA1c e glicemia em jejum comparadas ao placebo (Tabela 3).
Tabela 3: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-026)
| - | Placebo | Cloridrato de Pioglitazona 30 mg/dia* |
População total | ||
HbA1C (%) | N = 93 | N = 100 |
Basal (média) | 10,3 | 10,5 |
Mudança do basal (média ajustada*) | 0,8 | -0,6 |
Diferença do placebo (média ajustada*) | - | 1,4† |
Glicemia de jejum (mg/dL) | N = 91 | N = 99 |
Basal (média) | 270 | 273 |
Mudança do basal (média ajustava*) | 8 | -50 |
Diferença do placebo (média ajustada*) | - | -58† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo.
Terapia Combinada
Três estudos de 16 semanas e três de 24 semanas avaliaram os efeitos de Cloridrato de Pioglitazona em pacientes com diabetes tipo 2 com controle inadequado apesar de terapia com sulfonilureia, metformina ou insulina.
Estudos de associação a sulfonilureias
Dois estudos clínicos avaliaram Cloridrato de Pioglitazona combinado com sulfonilureia. Todos os outros agentes antidiabéticos foram retirados pelo menos três semanas antes.
Estudo de 16 semanas com associação a sulfonilureia (Estudo PNFP-010)
Em estudo de 16 semanas, 560 pacientes receberam 15 mg ou 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia, além de sulfonilureia. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum comparadas a placebo + sulfonilureia (Tabela 4).
Tabela 4: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-010)
| - | Placebo + Sulfonilureia | Cloridrato de Pioglitazona 15 mg + sulfonilureia | Cloridrato de Pioglitazona 30 mg + sulfonilureia |
População total | |||
HbA1C (%) | N = 181 | N = 176 | N = 182 |
Basal (média) | 9,9 | 10,0 | 9,9 |
Mudança do basal (média ajustada*) | 0,1 | -0,8 | -1,2 |
Diferença do placebo + sulfonilureia (média ajustada*) | - | -0,9† (-1,2, -0,6) | -1,3† |
Glicemia de jejum (mg/dL) | N = 182 | N = 179 | N = 186 |
Basal (média) | 236 | 247 | 239 |
Mudança do basal (média ajustada*) | 6 | -34 | -52 |
Diferença do placebo + sulfonilureia (média ajustada*) | - | -39† (-52, -27) | -58† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + sulfonilureia.
Estudo de 24 semanas com associação à sulfonilureia (Estudo PNFP-341)
Em estudo de 24 semanas, 702 pacientes receberam 30 mg ou 45 mg de Cloridrato de Pioglitazona uma vez ao dia, além de sulfonilureia. A redução média de HbA1c foi de 1,6% para 30 mg e 1,7% para 45 mg (Tabela 5). A redução média de glicemia em jejum foi de 52 mg/dL para 30 mg e 56 mg/dL para 45 mg.
Tabela 5: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-341)
| - | Cloridrato de Pioglitazona 30 mg + sulfonilureia | Cloridrato de Pioglitazona 45 mg + sulfonilureia |
População total | ||
HbA1C (%) | N = 340 | N = 332 |
Basal (média) | 9,8 | 9,9 |
Mudança do basal (média ajustada*) | -1,6 | -1,7 |
Diferença de Cloridrato de Pioglitazona 30 mg + sulfonilureia (média ajustada*) 95% IC | - | -0,1 |
Glicemia de jejum (mg/dL) | N = 338 | N = 329 |
Basal (média) | 214 | 217 |
Mudança do basal (média ajustada*) | -52 | -56 |
Diferença de Cloridrato de Pioglitazona 30 mg + sulfonilureia (média ajustada*) 95% IC | - | -5 |
95% IC = Intervalo de confiança 95%.
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
Estudos de associação à metformina
Dois estudos clínicos avaliaram Cloridrato de Pioglitazona combinado com metformina. Todos os outros agentes antidiabéticos foram retirados pelo menos três semanas antes.
Estudo de 16 semanas com associação à metformina (Estudo PNFP-027)
Em estudo de 16 semanas, 328 pacientes receberam 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia, além de metformina. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum comparadas a placebo + metformina (Tabela 6).
Tabela 6: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-027)
| - | Placebo + metformina | Cloridrato de Pioglitazona 30 mg + metformina |
População total | ||
HbA1C (%) | N = 153 | N = 161 |
Basal (média) | 9,8 | 9,9 |
Mudança do basal (média ajustada*) | 0,2 | -0,6 |
Diferença do placebo + metformina (média ajustada*) | - | -0,8† |
Glicemia de jejum (mg/dL) | N = 157 | N = 165 |
Basal (média) | 260 | 254 |
Mudança do basal (média ajustada*) | -5 | -43 |
Diferença do placebo + metformina (média ajustada*) | - | -38† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + metformina.
Estudo de 24 semanas com associação à metformina (Estudo PNFP-342)
Em estudo de 24 semanas, 827 pacientes receberam 30 mg ou 45 mg de Cloridrato de Pioglitazona uma vez ao dia, além de metformina. A redução média de HbA1c foi de 0,8% para 30 mg e 1,0% para 45 mg (Tabela 7). A redução média de glicemia em jejum foi de 38 mg/dL para 30 mg e 51 mg/dL para 45 mg.
Tabela 7: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-342)
| - | Cloridrato de Pioglitazona 30 mg + metformina | Cloridrato de Pioglitazona 45 mg + metformina |
População total | ||
HbA1C (%) | N = 400 | N = 398 |
Basal (média) | 9,9 | 9,8 |
Mudança do basal (média ajustada*) | -0,8 | -1,0 |
Diferença de Cloridrato de Pioglitazona 30 mg + metformina (média ajustada*) 95% IC | - | -0,2 |
Glicemia de jejum (mg/dL) | N = 398 | N = 399 |
Basal (média) | 233 | 232 |
Mudança do basal (média ajustada*) | -38 | -51 |
Diferença de Cloridrato de Pioglitazona 30 mg + metformina (média ajustada*) 95% IC | - | -12† |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Cloridrato de Pioglitazona 30 mg + metformina.
Estudos de associação à insulina
Dois estudos clínicos avaliaram Cloridrato de Pioglitazona combinado com insulina. Todos os outros agentes antidiabéticos foram retirados antes do início.
Estudo de associação à insulina (Estudo PNFP-014)
Em estudo de 16 semanas, 566 pacientes receberam 15 mg ou 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia, além de insulina. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum comparadas a placebo + insulina (Tabela 8).
Tabela 8: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-014)
| - | Placebo + insulina | Cloridrato de Pioglitazona 15 mg + insulina | Cloridrato de Pioglitazona 30 mg + insulina |
População total | |||
HbA1C (%) | N = 177 | N = 177 | N = 185 |
Basal (média) | 9,8 | 9,8 | 9,8 |
Mudança do basal (média ajustada*) | -0,3 | -1,0 | -1,3 |
Diferença do placebo + insulina (média ajustada*) Intervalo de Confiança 95% | - | -0,7† (-1,0, -0,5) | -1,0† |
Glicemia de jejum (mg/dL) | N = 179 | N = 183 | N = 184 |
Basal (média) | 221 | 222 | 229 |
Mudança do basal (média ajustada*) | 1 | -35 | -48 |
Diferença do placebo + insulina (média ajustada*) Intervalo de Confiança 95% | - | -35† | -49† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + insulina.
Estudo de 24 semanas com associação à insulina (Estudo PNFP-343)
Em estudo de 24 semanas, 690 pacientes receberam 30 mg ou 45 mg de Cloridrato de Pioglitazona uma vez ao dia, além de insulina. A redução média de HbA1c foi de 1,2% para 30 mg e 1,5% para 45 mg. A redução média de glicemia em jejum foi de 32 mg/dL para 30 mg e 46 mg/dL para 45 mg (Tabela 9).
Tabela 9: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-343)
| - | Cloridrato de Pioglitazona 30 mg + insulina | Cloridrato de Pioglitazona 45 mg + insulina |
População total | ||
HbA1C (%) | N = 328 | N = 328 |
Basal (média) | 9,9 | 9,7 |
Mudança do basal (média ajustada*) | -1,2 | -1,5 |
Diferença de Cloridrato de Pioglitazona 30 mg + insulina (média ajustada*) 95% IC | - | -0,3† |
Glicemia de jejum (mg/dL) | N = 325 | N = 327 |
Basal (média) | 202 | 199 |
Mudança do basal (média ajustada*) | -32 | -46 |
Diferença de Cloridrato de Pioglitazona 30 mg + insulina (média ajustada*) 95% IC | - | -14† |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Cloridrato de Pioglitazona 30 mg + insulina.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Tiazolidinodionas.
Código ATC: A10BG03.
Mecanismo de ação
O Cloridrato de Pioglitazona é uma tiazolidinodiona que depende da presença de insulina. Diminui a resistência à insulina na periferia e no fígado, aumentando a eliminação de glicose e diminuindo a produção hepática de glicose. Não estimula a secreção de insulina.
O Cloridrato de Pioglitazona é um agonista do receptor γ de peroxissomo proliferador-ativado (PPARγ), encontrado em tecidos importantes para a ação da insulina. A ativação modula genes envolvidos no controle da glicose e metabolismo lipídico.
Em modelos animais, reduz hiperglicemia, hiperinsulinemia e hipertrigliceridemia característica de resistência à insulina.
Segurança cardiovascular
Estudos clínicos mostraram ocorrência de insuficiência cardíaca em pacientes usando Actos® com insulina. Sinais: falta de ar, ganho rápido de peso ou inchaço.
Estudo PROactive avaliou 5.238 pacientes com diabetes tipo 2 e histórico de doença macrovascular tratados com Cloridrato de Pioglitazona ou placebo além do tratamento padrão. Não houve diferença significativa no desfecho primário composto, mas observou-se maior incidência de insuficiência cardíaca com Cloridrato de Pioglitazona.
Tabela 10: Eventos cardiovasculares no estudo PROactive
Eventos | Fármaco coadministrado | ||||
Dose de Cloridrato de Pioglitazona (mg) | Nome e regime de dose | Alteração na ASC† | Alteração no Cmáx† | ||
45mg (N = 12) Estudo EC-221 | Varfarina‡ | ||||
Dose diária, seguida de dose de manutenção baseada nos valores de TP e INR Valores Quick = 35 ± 5% | R-varfarina | ↓3% | R-varfarina | ↓2% | |
S-varfarina | ↓1% | S-varfarina | ↑1% | ||
45 mg (N = 12) Estudo EC-222 | Digoxina | ||||
0,200mg duas vezes ao dia (dose de carga), seguida de 0,250mg diariamente (dose de manutenção, 7 dias) | ↓15% | ↓17% | |||
45mg diariamente por 21 dias (N = 35) Estudo OPI513 | Contraceptivo oral | ||||
[Etinilestradiol (EE) 0,035mg somando a Noretindrona (NE) 1mg] por 21 dias | EE | ↓11% | EE | ↓13% | |
NE | ↓3% | NE | ↓7% | ||
45 mg (N = 23) Estudos PNFP037 | Fexofenadina | ||||
60mg duas vezes ao dia, por 7 dias | ↓30% | ↑37% | |||
45 mg (N = 14) | Glipizida | ||||
5mg diariamente por 7 dias | ↓3% | ↓8% | |||
45 mg diariamente por 8 dias (N = 16) Estudo EC-223 | Metformina | ||||
| 1000 mg dose única no Dia 8 | ↓3% | ↓5% | |||
45 mg (N = 21) Estudo PNFP-345 | Midazolam | ||||
7,5mg dose única no Dia 15 | ↓26% | ↓26% | |||
45 mg (N = 24) Estudo PNFP-038 | Ranitidina | ||||
| 150 mg duas vezes ao dia por 7 dias | ↑1% | ↓1% | |||
45 mg diariamente por 4 dias (N = 24) Estudo PNFP-040 | Nifedipina liberação modificada | ||||
30 mg diariamente por 4 dias | ↓13% | ↓17% | |||
45 mg (n = 25) Estudo PNFP-039 | Atorvastatina Cálcica | ||||
| 80 mg diariamente por 7 dias | ↓14% | ↓23% | |||
45 mg (N = 22) Estudo OPI-510 | Teofilina | ||||
| 400 mg duas vezes por dia por 7 dias | ↑2% | ↑5% | |||
*Diariamente por 7 dias salvo disposição ao contrário.
† % de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam o aumento ou redução da exposição, respectivamente.
‡O Cloridrato de Pioglitazona não possui efeito clínico significante no tempo de protrombina.
Tabela 12: Efeitos da coadministração de Cloridrato de Pioglitazona na exposição sistêmica o Cloridrato de Pioglitazona
Fármaco coadministrado e regime de dose | Cloridrato de Pioglitazona | ||
| Regime de dose (mg)* | Alteração na ASC† | Alteração no Cmáx† | |
Genfibrozila 600mg duas vezes ao dia por 2 dias (N = 12) Jaakota at al 2005 | 15 mg dose única | ↑3,2 vezes | ↑6% |
Cetoconazol 200mg duas vezes ao dia por 7 dias (N = 28) Study OPI - 517 | 45 mg | ↑34% | ↑14% |
Rifampicina 600mg diariamente por 5 dias (N = 10) Jaakota et al 2005 | 30 mg dose única | ↓54% | ↓5% |
Fexofenadina 60mg duas vezes por dia por 7 dias (N = 23) Study PNFP-037 | 45 mg | ↑1% | 0% |
Ranitidina 150mg duas vezes por dia por 4 dias (N = 23) Study PNFP-038 | 45 mg | ↓13% | ↓16% |
Nifedipina liberação modificada 30 mg diariamente por 7 dias (N = 23) Study PNFP-40 | 45 mg | ↑5% | ↑4% |
Atorvastatina Ca 80mg diariamente por 7 dias (N = 24) Study PNFP-039 | 45 mg | ↓24% | ↓31% |
Teofilina 400mg duas vezes por dia por 7 dias (N = 22) Study OPI-510 | 45 mg | ↓4% | ↓2% |
*Diariamente por 7 dias salvo disposição ao contrário.
Razão média (com/sem fármaco coadministrado e sem alteração = 1 vez);
% de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam o aumento ou redução da exposição, respectivamente.

 Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)
Revisado por Isabelle Baião de Mello Neto (CRF-MG 24309)