Para que serve o Brineura?
Brineura é usado para tratar pacientes com lipofuscinose ceróide neuronal tipo 2 (CLN2), uma condição também chamada de deficiência de tripeptidil-peptidase 1 (TPP1).
Como o Brineura age no corpo?
Brineura contém o componente ativo alfacerliponase, que faz parte dos medicamentos de reposição enzimática.
Pessoas com CLN2 têm falta ou redução da enzima TPP1, causando acúmulo de substâncias chamadas depósitos lisossômicos. Esse acúmulo ocorre principalmente no cérebro.
Brineura repõe a enzima TPP1 faltante, reduzindo o acúmulo desses depósitos. Isso ajuda a desacelerar o avanço da doença.
Quando não usar Brineura?
Não use Brineura se:
- Você já teve reação alérgica grave à alfacerliponase ou a qualquer componente do remédio, e essas reações continuaram ao tentar usar novamente.
- Você possui um dispositivo implantado para drenagem de líquido cerebral.
- Houver sinais de infecção no dispositivo ou problemas relacionados a ele. O tratamento pode ser retomado após resolver esses problemas.
Como aplicar o Brineura?
Será necessário cirurgia para implantar um dispositivo que permita a aplicação do medicamento diretamente no cérebro.
A aplicação é feita por médico especializado em infusão intracerebroventricular (no líquido cerebral), em ambiente hospitalar.
Não há dados suficientes sobre uso em menores de 2 anos ou acima de 8 anos (no início dos estudos).
A dose recomendada varia conforme a idade, aplicada a cada duas semanas:
- Recém-nascidos até 6 meses: 100 mg
- 6 meses a 1 ano: 150 mg
- 1 ano a 2 anos: 200 mg (4 primeiras doses), depois 300 mg
- Acima de 2 anos: 300 mg
O médico pode ajustar a dose ou tempo de infusão caso ocorram reações adversas, alergias ou alterações na pressão cerebral.
A aplicação é lenta através do dispositivo. Após o medicamento, uma solução adicional é infundida para garantir que toda dose chegue ao cérebro. O processo completo leva 2 a 4,5 horas, dependendo da dose. O médico pode reduzir velocidade ou dose conforme necessidade.
Medicamentos como antialérgicos ou antitérmicos podem ser receitados antes da aplicação para reduzir efeitos colaterais.
Siga exatamente as orientações médicas sobre horários, doses e duração do tratamento.
Não pare o tratamento sem consultar seu médico.
O que fazer ao perder uma dose?
Se você perdeu uma aplicação de Brineura, contate imediatamente seu médico.
Em caso de dúvida, consulte seu médico ou farmacêutico.
Precauções ao usar Brineura
Problemas com o dispositivo
Converse com seu médico antes de iniciar o tratamento.
Podem ocorrer infecções ou falhas no dispositivo implantado. Sintomas de infecção incluem febre, dor de cabeça, rigidez nucal, sensibilidade à luz, náuseas, vômitos e confusão mental.
Sinais de problemas no dispositivo: inchaço, vermelhidão no couro cabeludo, vazamento de líquido ou abaulamento. O tratamento pode ser pausado para substituição do dispositivo ou tratamento de infecção.
Reações alérgicas graves
Podem ocorrer reações alérgicas com risco de vida. Seu médico monitorará sintomas como urticária, coceira, inchaço facial, calafrios, taquicardia, falta de ar, rouquidão, lábios azulados, desmaio ou diarreia. Busque ajuda médica imediata se surgirem.
Monitoramento necessário
Seu médico verificará frequência cardíaca, pressão arterial, respiração e temperatura antes, durante e após cada aplicação.
Eletrocardiograma será realizado a cada 6 meses. Pacientes com histórico cardíaco terão monitoramento durante toda infusão. Amostras de líquido cerebral podem ser analisadas para detectar infecções.
Uso em crianças
Não há dados suficientes para crianças menores de 2 anos ou com doença avançada. Converse com o médico sobre a adequação do tratamento.
Teor de sódio
Cada frasco contém 17,42 mg de sódio. Pacientes com dieta controlada em sódio devem considerar esse valor.
Gravidez
Não use durante a gravidez sem orientação médica. O tratamento só deve ocorrer se claramente necessário.
Não utilize durante a gestação sem acompanhamento médico.
Amamentação
Não se sabe se Brineura passa para o leite materno. A amamentação deve ser suspensa durante o tratamento.
Dirigir e operar máquinas
Não se sabe se afeta a capacidade de dirigir ou operar máquinas. Consulte seu médico.
Efeitos colaterais do Brineura
Como todo medicamento, Brineura pode causar reações adversas, embora não em todos os pacientes.
Procure seu médico imediatamente se tiver:
- Reações muito comuns (acima de 10% dos pacientes): febre, vômitos, irritabilidade, infecções no dispositivo, convulsões, reações durante/sapós aplicação (urticária, coceira, inchaço facial, falta de ar, lábios azulados, desmaio).
- Reações comuns (1-10% dos pacientes): redução da frequência cardíaca, reação anafilática.
Outros efeitos relatados:
- Muito comuns: dor de cabeça, aumento de proteínas no líquido cerebral, infecções respiratórias, hematomas, pressão baixa, vazamento do dispositivo.
- Comuns: erupções cutâneas, dor abdominal, aftas, conjuntivite, nervosismo, problemas digestivos.
Reações com frequência desconhecida:
- Inflamação cerebral por infecções relacionadas ao dispositivo.
Atenção: Por ser medicamento novo, podem ocorrer efeitos desconhecidos. Informe seu médico sobre qualquer reação incomum.
Apresentações do Brineura
Solução para infusão 30 mg/mL
- Embalagem com 3 frascos: 2 frascos de Brineura 150 mg/5 mL e 1 frasco com 5 mL de solução de lavagem.
Uso intracerebroventricular.
Para adultos e crianças.
Composição do Brineura
Cada frasco de Brineura contém:
150 mg de alfacerliponase em 5 mL de solução.
Cada mL da solução contém:
30 mg de alfacerliponase.
Componentes inativos: fosfato de sódio dibásico heptaidratado, fosfato de sódio monobásico monoidratado, cloreto de sódio, cloreto de potássio, cloreto de magnésio hexaidratado, cloreto de cálcio di-hidratado, água para injetáveis.
O que ocorre em caso de superdose?
Não há informações sobre superdose com Brineura.
Em caso de uso excessivo, busque atendimento médico imediato e leve a embalagem. Ligue para 0800 722 6001 para orientações.
Interações com outros medicamentos
Não são conhecidas interações entre Brineura e outros remédios. Informe seu médico sobre qualquer medicamento em uso.
Converse com seu médico antes de usar outros medicamentos.
Não use remédios sem orientação médica.
Como o Brineura age no organismo?
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo terapêutico: Enzimas para distúrbios metabólicos.
Código ATC: A16AB17.
Mecanismo de ação
A alfacerliponase é uma forma recombinante da enzima humana TPP1. É uma pró-enzima inativada que se torna ativa nos lisossomos. A enzima é absorvida pelas células e direcionada aos lisossomos através de receptores específicos.
A enzima ativada decompõe tripéptidos de proteínas-alvo. A falta de TPP1 causa CLN2, levando à neurodegeneração.
Resultados clínicos
Eficácia e segurança foram avaliadas em estudos com pacientes CLN2 comparados a grupo controle. Utilizou-se escala específica que avalia função motora (0-3 pontos) e de linguagem (0-3 pontos), total máximo 6 pontos.
Tabela 3: Escala de avaliação clínica na CLN2
| Domínio | Pontuação | Classificação |
| Motor | 3 | Marcha normal sem quedas |
| 2 | Caminha 10 passos sem apoio, mas com instabilidade | |
| 1 | Precisa de ajuda para andar ou só rasteja | |
| 0 | Não anda nem rasteja | |
| Linguagem | 3 | Linguagem normal para idade |
| 2 | Linguagem anormal, frases curtas para necessidades | |
| 1 | Poucas palavras compreensíveis | |
| 0 | Sem palavras compreensíveis |
24 pacientes (3-8 anos) receberam 300mg a cada 2 semanas. A pontuação média inicial foi 3.5. Comparados ao grupo controle, 87% não tiveram declínio de 2 pontos após 48 semanas.
Tabela 4: Taxa de declínio após 48 semanas
| Taxa de declínio (pontos/48 semanas)a | Total (n = 23) | Valor pb |
| Média (DP) | 0,40 (0,809)c | < 0,0001 |
| Mediana | 0,00 | |
| Mín., máx. | -0,88; 2,02 | |
| Limites do IC de 95% | 0,05; 0,75 |
a Variação na pontuação por 48 semanas.
b Comparado com declínio esperado de 2 pontos.
c Valores positivos indicam piora; negativos indicam melhora.
Figura 2: Alteração média na pontuação CLN2 (Grupo controle vs. tratados)
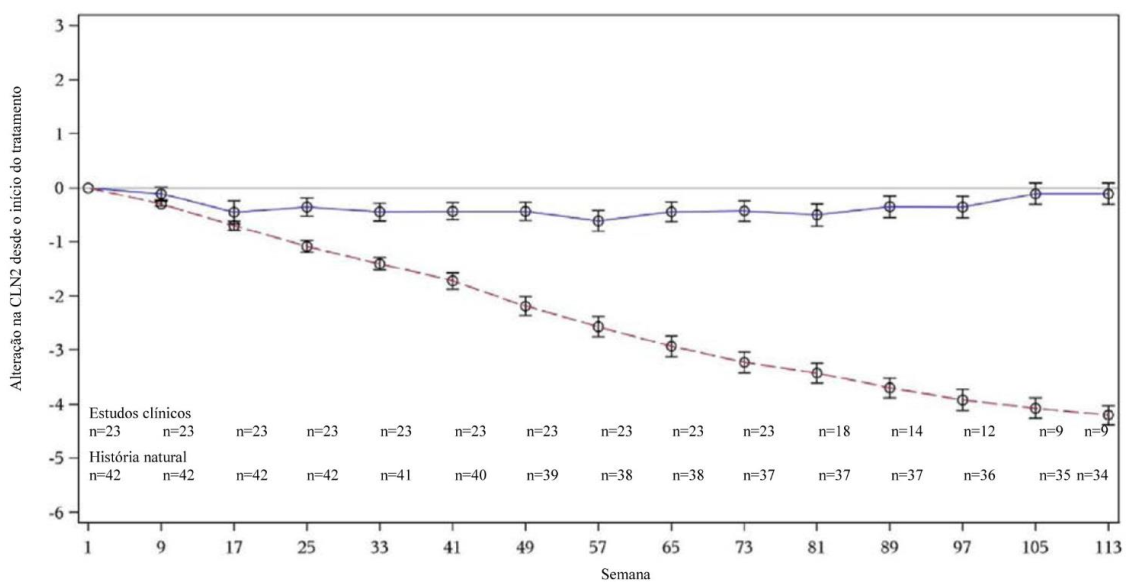
Linha contínua: estudos clínicos. Linha tracejada: Grupo controle histórico.
Uso em crianças
O tratamento deve começar cedo, embora não haja dados suficientes para menores de 3 anos. Um estudo em andamento avalia segurança em recém-nascidos até 18 anos.
Propriedades farmacocinéticas
Farmacocinética avaliada em pacientes CLN2 recebendo 300mg intracerebroventricular a cada 2 semanas.
Tabela 5: Propriedades farmacocinéticas no líquido cefalorraquidiano (LCR)
| Parâmetro | LCR (N=17) / Média (DP) |
| Tmáx.*, h | 4,50 [4,25; 5,75] |
| Cmáx., µg/mL | 1490 (942) |
| AUC0–t, µg·h/mL | 9510 (4130) |
| Vd, mL | 435 (412) |
| Cl, mL/h | 38,7 (19,8) |
| t1/2, h | 7,35 (2,90) |
* Tempo medido desde início da infusão
Distribuição
O volume de distribuição sugere que parte do medicamento atinge tecidos além do LCR, porém a maior concentração permanece no sistema nervoso central.
Eliminação
A alfacerliponase é metabolizada por hidrólise peptídica. Função hepática comprometida não deve afetar sua farmacocinética.
Excreção
A eliminação renal é considerada secundária.
Estudos pré-clínicos
Dados limitados de segurança foram obtidos em estudos com primatas e cães. Devido a limitações metodológicas, esses resultados não permitem prever completamente a segurança em humanos.
Armazenamento do Brineura
Guarde os frascos na posição vertical em freezer (-25°C a -15°C).
Mantenha na embalagem original protegida da luz.
Verifique o lote e validade na embalagem.
Não use após o vencimento.
Após descongelar, use imediatamente. Se não for possível, guarde em geladeira (2-8°C) e utilize dentro de 24 horas.
Estabilidade física foi demonstrada por até 12 horas em temperatura ambiente (19-25°C). Microbiologicamente, o produto aberto deve ser usado imediatamente.
Após abertura, utilize imediatamente.
Médicos e farmacêuticos são responsáveis pelo armazenamento e descarte adequado.
Aspecto físico
Brineura é líquido transparente ou levemente opaco, incolor a amarelo claro. Pode conter partículas ou fibras finas.
Solução de lavagem é transparente e incolor.
Se observar alterações no aspecto, consulte o farmacêutico.
Mantenha fora do alcance de crianças.
Dizeres Legais do Brineura
MS: 1.7333.0003.001-7
Farmacêutica responsável:
Helena Satie Komatsu
CRF-SP n° 19714
Registrado e importado por:
BioMarin Brasil Farmacêutica Ltda.
Rua James Joule, 92, São Paulo/SP
CEP 04576-080
CNPJ 08.002.360/0001-34
Fabricado por:
Vetter Pharma-Fertigung GmbH & Co. KG, Alemanha
Embalado por:
AndersonBrecon (UK) Ltd., Reino Unido
ou
Almac Pharma Services, Irlanda
SAC
0800-722-0350
Uso hospitalar sob prescrição médica.
Venda restrita a hospitais.

 Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 30 de julho de 2025.
Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 30 de julho de 2025.