Para que serve o Actos?
Actos® (cloridrato de pioglitazona) contém uma substância chamada cloridrato de pioglitazona.
Actos® é um remédio para diabetes usado junto com dieta e exercícios para controlar o açúcar no sangue em pacientes com diabetes tipo 2 (aquele que geralmente aparece em adultos).
Actos® pode ser usado sozinho ou combinado com outros remédios para diabetes como sulfonilureias, metformina ou insulina, principalmente quando dieta e exercícios não forem suficientes para controlar o açúcar no sangue.
O tratamento do diabetes tipo 2 também deve incluir orientação nutricional, perda de peso quando necessário e exercícios. Essas medidas são importantes não só para controlar o diabetes, mas também para manter a eficácia do remédio.
Como funciona o Actos?
Actos® ajuda a controlar o açúcar no sangue no diabetes tipo 2, melhorando a forma como seu corpo usa a insulina produzida.
Actos® pode ser usado em pacientes que não podem tomar metformina ou quando dieta e exercícios não controlam o açúcar no sangue. Pode ser combinado com outros tratamentos (como metformina, sulfonilureia ou insulina) que não tenham dado resultado suficiente.
Quem não pode tomar Actos?
Não use Actos®:
- Se você tem alergia a pioglitazona ou qualquer componente de Actos®;
- Se você tem ou já teve insuficiência cardíaca.
Como tomar Actos?
A dose recomendada é de um comprimido de Actos® uma vez ao dia por via oral. Seu médico pode ajustar a dose se necessário.
As doses iniciais mais comuns são de 15mg ou 30mg, podendo variar de 15 a 45mg. Seu médico indicará a dose correta para você.
Actos® com comida ou bebida
Você pode tomar os comprimidos com ou sem alimentos.
Engula os comprimidos com um copo de água.
Se achar que Actos® não está fazendo efeito, informe seu médico.
Quando Actos® é usado com outros remédios para diabetes (como insulina, clorpropamida, glibenclamida, gliclazida, tolbutamida), seu médico dirá se precisa ajustar as doses.
Seu médico pedirá exames de sangue periódicos durante o tratamento para verificar a função do fígado.
Se estiver em dieta para diabéticos, continue seguindo-a enquanto usar Actos®.
Seu peso será monitorado regularmente; se aumentar, avise seu médico.
Actos® deve ser usado todos os dias para funcionar corretamente. Se parar de usar, o açúcar no sangue pode subir. Converse com seu médico antes de interromper o tratamento.
Se tiver dúvidas sobre o uso deste remédio, fale com seu médico ou farmacêutico.
Siga as orientações do seu médico, respeitando horários, doses e duração do tratamento.
Não pare o tratamento sem orientação médica.
O que fazer se esquecer de tomar Actos?
Tome Actos® diariamente conforme prescrito. Se esquecer uma dose, tome o próximo comprimido no horário normal. Não tome dose dobrada para compensar.
Em caso de dúvidas, consulte o farmacêutico ou seu médico.
Precauções ao usar Actos
Informe seu médico antes de usar este remédio:
- Se você retém líquidos (inchaço) ou tem problemas cardíacos, especialmente se tiver mais de 75 anos. Se toma anti-inflamatórios que também causam inchaço, avise seu médico;
- Se você tem ou já teve câncer de bexiga;
- Se você tem uma doença ocular diabética chamada edema macular (inchaço na parte de trás do olho);
- Se você tem ovários policísticos. Pode aumentar a chance de engravidar, pois você pode ovular novamente. Use métodos contraceptivos adequados para evitar gravidez não planejada;
- Se você tem doença no fígado ou coração. Antes de iniciar o tratamento, será feito exame de sangue para avaliar a função hepática. Essa avaliação pode se repetir. Alguns pacientes com diabetes tipo 2 há muito tempo e doença cardíaca ou derrame prévio que usaram Actos® e insulina desenvolveram insuficiência cardíaca. Informe seu médico imediatamente se tiver sinais como falta de ar, ganho rápido de peso ou inchaço;
- Se você tem diabetes tipo 1, pois Actos® só funciona na presença de insulina produzida pelo corpo. Não é indicado para diabetes tipo 1 ou cetoacidose diabética;
- Se você tem alterações nos níveis de hemoglobina, pois pode ocorrer leve redução nos níveis de hemoglobina no sangue.
Se usar Actos® com outros remédios para diabetes, é mais provável que o açúcar no sangue caia abaixo do normal (hipoglicemia).
Você também pode ter redução do volume sanguíneo (anemia).
Fratura dos ossos
Foi observado maior número de fraturas em pacientes, especialmente mulheres, em tratamento com pioglitazona. Seu médico considerará isso no seu tratamento.
Crianças
Não é recomendado para pacientes menores de 18 anos.
Gravidez e amamentação
Informe seu médico se você:
- Está grávida, suspeita estar ou planeja engravidar;
- Está amamentando ou planeja amamentar.
Seu médico dirá se deve parar este medicamento.
Dirigir ou operar máquinas
Actos® não afeta sua habilidade de dirigir ou usar máquinas, mas fique atento se tiver alterações visuais.
Informação importante sobre alguns componentes de Actos®:
Este remédio contém lactose. Se você tem intolerância a açúcares, consulte seu médico antes de tomar Actos®.
Este remédio não deve ser usado por grávidas sem orientação médica.
Informe seu médico se engravidar durante ou após o tratamento. Informe se está amamentando.
Efeitos colaterais do Actos
Como todos os remédios, Actos® pode causar efeitos colaterais, embora nem todos os apresentem.
Em particular, os pacientes apresentaram os seguintes efeitos colaterais graves:
- Insuficiência cardíaca ocorreu frequentemente (1 a 10 em 100 usuários) em pacientes usando Actos® com insulina. Sintomas: falta de ar incomum, ganho rápido de peso ou inchaço. Se tiver algum destes, especialmente se tiver mais de 65 anos, busque ajuda médica imediatamente;
- Câncer de bexiga ocorreu pouco frequentemente (1 a 10 em 1000 usuários) em pacientes usando Actos®. Sinais: sangue na urina, dor ao urinar ou vontade súbita de urinar. Se tiver algum destes, informe seu médico o quanto antes;
- Inchaço (edema) também ocorreu muito frequentemente com Actos® e insulina. Se tiver, converse com seu médico;
- Fraturas ósseas ocorreram frequentemente (1 a 10 em 100 usuários) em mulheres usando Actos®. Se tiver, converse com seu médico;
- Visão turva devido a inchaço na parte de trás do olho (frequência desconhecida) foi relatada. Se tiver pela primeira vez ou piorar, consulte seu médico;
- Reações alérgicas (frequência desconhecida). Se tiver reação alérgica grave, incluindo urticária e inchaço do rosto, lábios, língua ou garganta que dificulte respirar, pare de usar e procure médico imediatamente.
Outros efeitos colaterais relatados:
Frequentes (afetam 1 a 10 em 100 usuários):
- Infecção respiratória;
- Visão anormal;
- Ganho de peso;
- Formigamento.
Pouco frequentes (afetam 1 a 10 em 1000 usuários):
- Inflamação nasal (sinusite);
- Dificuldade para dormir (insônia).
Frequência desconhecida:
- Aumento de enzimas do fígado;
- Reações alérgicas.
Efeitos colaterais quando usado com outros remédios para diabetes:
Muito frequentes (afeta mais de 1 em 10 usuários):
- Queda do açúcar no sangue (hipoglicemia).
Frequentes (afetam 1 a 10 em 100 usuários):
- Dor de cabeça;
- Tontura;
- Dor nas articulações;
- Impotência;
- Dor nas costas;
- Falta de ar;
- Pequena redução de glóbulos vermelhos;
- Gases;
- Formigamento.
Pouco frequentes (afetam 1 a 10 em 1000 usuários):
- Açúcar e proteínas na urina;
- Aumento de enzimas;
- Tontura (vertigem);
- Suor;
- Cansaço;
- Aumento de apetite;
- Inflamação nasal (sinusite);
- Insônia.
Se qualquer efeito colateral for grave, ou se observar algum não listado, informe seu médico ou farmacêutico.
Informe ao seu médico ou farmacêutico o aparecimento de reações indesejadas. Informe também à empresa pelo serviço de atendimento.
Apresentações do Actos
Actos® (cloridrato de pioglitazona) comprimido de 15 mg
Frasco com 15 comprimidos.
Actos® (cloridrato de pioglitazona) comprimido de 30 mg
Frasco com 15 comprimidos.
Actos® (cloridrato de pioglitazona) comprimido de 45 mg
Frasco com 15 comprimidos.
Uso oral.
Uso adulto.
Composição do Actos
Cada comprimido de Actos® 15 mg contém:
Cloridrato de pioglitazona 16,53 mg (equivalente a 15 mg de pioglitazona).
Componentes: lactose monoidratada, hiprolose, carmelose cálcica, estearato de magnésio.
Cada comprimido de Actos® 30 mg contém:
Cloridrato de pioglitazona 33,05 mg (equivalente a 30 mg de pioglitazona).
Componentes: lactose monoidratada, hiprolose, carmelose cálcica, estearato de magnésio.
Cada comprimido de Actos® 45 mg contém:
Cloridrato de pioglitazona 49,59 mg (equivalente a 45 mg de pioglitazona).
Componentes: lactose monoidratada, hiprolose, carmelose cálcica, estearato de magnésio.
Overdose de Actos: o que fazer?
Se tomar mais comprimidos do que o recomendado, ou se outra pessoa ou criança tomar seu remédio, informe seu médico ou farmacêutico imediatamente. O açúcar no sangue pode cair abaixo do normal e pode ser aumentado ingerindo açúcar. Recomenda-se ter pacotes de açúcar, doces, biscoitos ou suco adoçado.
Em caso de overdose, busque socorro médico imediato e leve a embalagem ou bula. Ligue para 0800 722 6001 para orientações.
Interações do Actos com outros remédios
Informe seu médico ou farmacêutico se estiver usando ou usou recentemente qualquer outro remédio, inclusive sem receita.
Geralmente, você pode usar outros remédios com Actos®. Porém, alguns podem afetar o açúcar no sangue:
- Genfibrozila (para reduzir colesterol);
- Rifampicina (para tratar tuberculose e infecções).
Informe seu médico se estiver tomando um deles. Seu açúcar no sangue será monitorado e pode ser necessário ajustar a dose de Actos®.
Informe ao seu médico se você está usando outro medicamento.
Não use remédios sem conhecimento do seu médico. Pode ser perigoso.
Como o Actos age no organismo?
Resultados de Eficácia
Monoterapia
Três estudos com duração de 16 a 26 semanas avaliaram Cloridrato de Pioglitazona em monoterapia em pacientes com diabetes tipo 2. Esses estudos avaliaram doses de até 45 mg ou placebo uma vez ao dia em 865 pacientes.
Estudo de variação de dose (Estudo PNFP-001)
Em estudo de monoterapia de 26 semanas, 408 pacientes com diabetes tipo 2 receberam 7,5 mg, 15 mg, 30 mg ou 45 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia. O tratamento anterior foi interrompido 8 semanas antes. Doses de 15 mg, 30 mg e 45 mg produziram melhorias significativas na HbA1c e glicemia em jejum comparadas ao placebo.
Figura 1 mostra a alteração na HbA1c ao longo de 26 semanas.
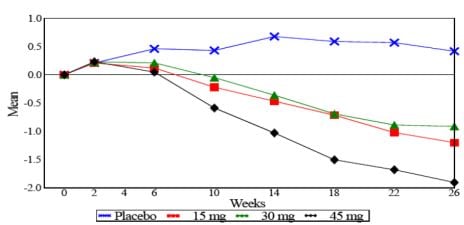
Tabela 1: Parâmetros glicêmicos em 26 semanas (Estudo PNFP-001)
| - | Placebo | Cloridrato de Pioglitazona 15 mg/dia | Cloridrato de Pioglitazona 30mg/dia | Cloridrato de Pioglitazona 45mg/dia |
População total | ||||
HbA1C (%) | N = 79 | N = 79 | N = 85 | N = 76 |
Basal (média) | 10,4 | 10,2 | 10,2 | 10,3 |
Mudança do basal (média ajustada*) | 0,7 | -0,3 | -0,3 | -0,9 |
Diferença do placebo (média ajustada*) | - | -1,0† (-1,6, -0,4) | -1,0† (-1,6, -0,4) | -1,6† |
Glicemia de jejum (mg/dL) | N = 79 | N = 79 | N = 84 | N = 77 |
Basal (média) | 268 | 267 | 269 | 276 |
Mudança do basal (média ajustada*) | 9 | -30 | -32 | -56 |
Diferença do placebo (média ajustada*) | - | -39† (-63, -16) | -41† (-64, -18) | -65† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo.
Estudo de titulação de dose (Estudo PNFP-012)
Em estudo de monoterapia controlado por placebo de 24 semanas, 260 pacientes receberam doses tituladas de Cloridrato de Pioglitazona ou placebo. O tratamento anterior foi interrompido 6 semanas antes.
Em um grupo, pacientes receberam dose inicial de 7,5 mg/dia, aumentada para 15 mg/dia após 4 semanas, e para 30 mg/dia após mais 4 semanas. No outro grupo, iniciaram com 15 mg/dia e foram titulados para 30 mg/dia e 45 mg/dia.
O tratamento produziu melhorias significativas na HbA1c e glicemia em jejum comparadas ao placebo (Tabela 2).
Tabela 2: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-012)
| - | Placebo | Cloridrato de Pioglitazona 30 mg/dia* | Cloridrato de Pioglitazona 45 mg/dia* |
População total | |||
HbA1C (%) | N = 83 | N = 85 | N = 85 |
Basal (média) | 10,8 | 10,3 | 10,8 |
Mudança do basal (média ajustada*) | 0,9 | -0,6 | -0,6 |
Diferença do placebo (média ajustada*) | - | -1,5† (-2,0, -1,0) | -1,5† |
Glicemia de jejum (mg/dL) | N = 78 | N = 82 | N = 85 |
Basal (média) | 279 | 268 | 281 |
Mudança do basal (média ajustada*) | 18 | -44 | -50 |
Diferença do placebo (média ajustada*) | - | -62† (-82, -0,41) | -68† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
**Dose final em titulação forçada.
†p ≤ 0,05 vs. placebo.
Estudo de monoterapia de 16 semanas (Estudo PNFP-026)
Em estudo de 16 semanas, 197 pacientes receberam 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia. O tratamento anterior foi interrompido 6 semanas antes. A dose de 30 mg produziu melhorias significativas na HbA1c e glicemia em jejum comparadas ao placebo (Tabela 3).
Tabela 3: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-026)
| - | Placebo | Cloridrato de Pioglitazona 30 mg/dia* |
População total | ||
HbA1C (%) | N = 93 | N = 100 |
Basal (média) | 10,3 | 10,5 |
Mudança do basal (média ajustada*) | 0,8 | -0,6 |
Diferença do placebo (média ajustada*) | - | 1,4† |
Glicemia de jejum (mg/dL) | N = 91 | N = 99 |
Basal (média) | 270 | 273 |
Mudança do basal (média ajustava*) | 8 | -50 |
Diferença do placebo (média ajustada*) | - | -58† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo.
Terapia Combinada
Três estudos de 16 semanas e três de 24 semanas avaliaram os efeitos de Cloridrato de Pioglitazona em pacientes com diabetes tipo 2 com controle inadequado apesar de terapia com sulfonilureia, metformina ou insulina.
Estudos de associação a sulfonilureias
Dois estudos clínicos avaliaram Cloridrato de Pioglitazona combinado com sulfonilureia. Todos os outros agentes antidiabéticos foram retirados pelo menos três semanas antes.
Estudo de 16 semanas com associação a sulfonilureia (Estudo PNFP-010)
Em estudo de 16 semanas, 560 pacientes receberam 15 mg ou 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia, além de sulfonilureia. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum comparadas a placebo + sulfonilureia (Tabela 4).
Tabela 4: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-010)
| - | Placebo + Sulfonilureia | Cloridrato de Pioglitazona 15 mg + sulfonilureia | Cloridrato de Pioglitazona 30 mg + sulfonilureia |
População total | |||
HbA1C (%) | N = 181 | N = 176 | N = 182 |
Basal (média) | 9,9 | 10,0 | 9,9 |
Mudança do basal (média ajustada*) | 0,1 | -0,8 | -1,2 |
Diferença do placebo + sulfonilureia (média ajustada*) | - | -0,9† (-1,2, -0,6) | -1,3† |
Glicemia de jejum (mg/dL) | N = 182 | N = 179 | N = 186 |
Basal (média) | 236 | 247 | 239 |
Mudança do basal (média ajustada*) | 6 | -34 | -52 |
Diferença do placebo + sulfonilureia (média ajustada*) | - | -39† (-52, -27) | -58† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + sulfonilureia.
Estudo de 24 semanas com associação à sulfonilureia (Estudo PNFP-341)
Em estudo de 24 semanas, 702 pacientes receberam 30 mg ou 45 mg de Cloridrato de Pioglitazona uma vez ao dia, além de sulfonilureia. A redução média de HbA1c foi de 1,6% para 30 mg e 1,7% para 45 mg (Tabela 5). A redução média de glicemia em jejum foi de 52 mg/dL para 30 mg e 56 mg/dL para 45 mg.
Tabela 5: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-341)
| - | Cloridrato de Pioglitazona 30 mg + sulfonilureia | Cloridrato de Pioglitazona 45 mg + sulfonilureia |
População total | ||
HbA1C (%) | N = 340 | N = 332 |
Basal (média) | 9,8 | 9,9 |
Mudança do basal (média ajustada*) | -1,6 | -1,7 |
Diferença de Cloridrato de Pioglitazona 30 mg + sulfonilureia (média ajustada*) 95% IC | - | -0,1 |
Glicemia de jejum (mg/dL) | N = 338 | N = 329 |
Basal (média) | 214 | 217 |
Mudança do basal (média ajustada*) | -52 | -56 |
Diferença de Cloridrato de Pioglitazona 30 mg + sulfonilureia (média ajustada*) 95% IC | - | -5 |
95% IC = Intervalo de confiança 95%.
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
Estudos de associação à metformina
Dois estudos clínicos avaliaram Cloridrato de Pioglitazona combinado com metformina. Todos os outros agentes antidiabéticos foram retirados pelo menos três semanas antes.
Estudo de 16 semanas com associação à metformina (Estudo PNFP-027)
Em estudo de 16 semanas, 328 pacientes receberam 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia, além de metformina. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum comparadas a placebo + metformina (Tabela 6).
Tabela 6: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-027)
| - | Placebo + metformina | Cloridrato de Pioglitazona 30 mg + metformina |
População total | ||
HbA1C (%) | N = 153 | N = 161 |
Basal (média) | 9,8 | 9,9 |
Mudança do basal (média ajustada*) | 0,2 | -0,6 |
Diferença do placebo + metformina (média ajustada*) | - | -0,8† |
Glicemia de jejum (mg/dL) | N = 157 | N = 165 |
Basal (média) | 260 | 254 |
Mudança do basal (média ajustada*) | -5 | -43 |
Diferença do placebo + metformina (média ajustada*) | - | -38† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + metformina.
Estudo de 24 semanas com associação à metformina (Estudo PNFP-342)
Em estudo de 24 semanas, 827 pacientes receberam 30 mg ou 45 mg de Cloridrato de Pioglitazona uma vez ao dia, além de metformina. A redução média de HbA1c foi de 0,8% para 30 mg e 1,0% para 45 mg (Tabela 7). A redução média de glicemia em jejum foi de 38 mg/dL para 30 mg e 51 mg/dL para 45 mg.
Tabela 7: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-342)
| - | Cloridrato de Pioglitazona 30 mg + metformina | Cloridrato de Pioglitazona 45 mg + metformina |
População total | ||
HbA1C (%) | N = 400 | N = 398 |
Basal (média) | 9,9 | 9,8 |
Mudança do basal (média ajustada*) | -0,8 | -1,0 |
Diferença de Cloridrato de Pioglitazona 30 mg + metformina (média ajustada*) 95% IC | - | -0,2 |
Glicemia de jejum (mg/dL) | N = 398 | N = 399 |
Basal (média) | 233 | 232 |
Mudança do basal (média ajustada*) | -38 | -51 |
Diferença de Cloridrato de Pioglitazona 30 mg + metformina (média ajustada*) 95% IC | - | -12† |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Cloridrato de Pioglitazona 30 mg + metformina.
Estudos de associação à insulina
Dois estudos clínicos avaliaram Cloridrato de Pioglitazona combinado com insulina. Todos os outros agentes antidiabéticos foram retirados antes do início.
Estudo de associação à insulina (Estudo PNFP-014)
Em estudo de 16 semanas, 566 pacientes receberam 15 mg ou 30 mg de Cloridrato de Pioglitazona ou placebo uma vez ao dia, além de insulina. O tratamento combinado produziu melhorias significativas na HbA1c e glicemia em jejum comparadas a placebo + insulina (Tabela 8).
Tabela 8: Parâmetros glicêmicos em 16 semanas (Estudo PNFP-014)
| - | Placebo + insulina | Cloridrato de Pioglitazona 15 mg + insulina | Cloridrato de Pioglitazona 30 mg + insulina |
População total | |||
HbA1C (%) | N = 177 | N = 177 | N = 185 |
Basal (média) | 9,8 | 9,8 | 9,8 |
Mudança do basal (média ajustada*) | -0,3 | -1,0 | -1,3 |
Diferença do placebo + insulina (média ajustada*) Intervalo de Confiança 95% | - | -0,7† (-1,0, -0,5) | -1,0† |
Glicemia de jejum (mg/dL) | N = 179 | N = 183 | N = 184 |
Basal (média) | 221 | 222 | 229 |
Mudança do basal (média ajustada*) | 1 | -35 | -48 |
Diferença do placebo + insulina (média ajustada*) Intervalo de Confiança 95% | - | -35† | -49† |
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. placebo + insulina.
Estudo de 24 semanas com associação à insulina (Estudo PNFP-343)
Em estudo de 24 semanas, 690 pacientes receberam 30 mg ou 45 mg de Cloridrato de Pioglitazona uma vez ao dia, além de insulina. A redução média de HbA1c foi de 1,2% para 30 mg e 1,5% para 45 mg. A redução média de glicemia em jejum foi de 32 mg/dL para 30 mg e 46 mg/dL para 45 mg (Tabela 9).
Tabela 9: Parâmetros glicêmicos em 24 semanas (Estudo PNFP-343)
| - | Cloridrato de Pioglitazona 30 mg + insulina | Cloridrato de Pioglitazona 45 mg + insulina |
População total | ||
HbA1C (%) | N = 328 | N = 328 |
Basal (média) | 9,9 | 9,7 |
Mudança do basal (média ajustada*) | -1,2 | -1,5 |
Diferença de Cloridrato de Pioglitazona 30 mg + insulina (média ajustada*) 95% IC | - | -0,3† |
Glicemia de jejum (mg/dL) | N = 325 | N = 327 |
Basal (média) | 202 | 199 |
Mudança do basal (média ajustada*) | -32 | -46 |
Diferença de Cloridrato de Pioglitazona 30 mg + insulina (média ajustada*) 95% IC | - | -14† |
95% IC = Intervalo de confiança 95%
*Ajustado pela linha basal, centro-agrupado e centro-agrupado por interação do tratamento.
†p ≤ 0,05 vs. Cloridrato de Pioglitazona 30 mg + insulina.
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Tiazolidinodionas.
Código ATC: A10BG03.
Mecanismo de ação
O Cloridrato de Pioglitazona é uma tiazolidinodiona que depende da presença de insulina. Diminui a resistência à insulina na periferia e no fígado, aumentando a eliminação de glicose e diminuindo a produção hepática de glicose. Não estimula a secreção de insulina.
O Cloridrato de Pioglitazona é um agonista do receptor γ de peroxissomo proliferador-ativado (PPARγ), encontrado em tecidos importantes para a ação da insulina. A ativação modula genes envolvidos no controle da glicose e metabolismo lipídico.
Em modelos animais, reduz hiperglicemia, hiperinsulinemia e hipertrigliceridemia característica de resistência à insulina.
Segurança cardiovascular
Estudos clínicos mostraram ocorrência de insuficiência cardíaca em pacientes usando Actos® com insulina. Sinais: falta de ar, ganho rápido de peso ou inchaço.
Estudo PROactive avaliou 5.238 pacientes com diabetes tipo 2 e histórico de doença macrovascular tratados com Cloridrato de Pioglitazona ou placebo além do tratamento padrão. Não houve diferença significativa no desfecho primário composto, mas observou-se maior incidência de insuficiência cardíaca com Cloridrato de Pioglitazona.
Tabela 10: Eventos cardiovasculares no estudo PROactive
Eventos | Fármaco coadministrado | ||||
Dose de Cloridrato de Pioglitazona (mg) | Nome e regime de dose | Alteração na ASC† | Alteração no Cmáx† | ||
45mg (N = 12) Estudo EC-221 | Varfarina‡ | ||||
Dose diária, seguida de dose de manutenção baseada nos valores de TP e INR Valores Quick = 35 ± 5% | R-varfarina | ↓3% | R-varfarina | ↓2% | |
S-varfarina | ↓1% | S-varfarina | ↑1% | ||
45 mg (N = 12) Estudo EC-222 | Digoxina | ||||
0,200mg duas vezes ao dia (dose de carga), seguida de 0,250mg diariamente (dose de manutenção, 7 dias) | ↓15% | ↓17% | |||
45mg diariamente por 21 dias (N = 35) Estudo OPI513 | Contraceptivo oral | ||||
[Etinilestradiol (EE) 0,035mg somando a Noretindrona (NE) 1mg] por 21 dias | EE | ↓11% | EE | ↓13% | |
NE | ↓3% | NE | ↓7% | ||
45 mg (N = 23) Estudos PNFP037 | Fexofenadina | ||||
60mg duas vezes ao dia, por 7 dias | ↓30% | ↑37% | |||
45 mg (N = 14) | Glipizida | ||||
5mg diariamente por 7 dias | ↓3% | ↓8% | |||
45 mg diariamente por 8 dias (N = 16) Estudo EC-223 | Metformina | ||||
| 1000 mg dose única no Dia 8 | ↓3% | ↓5% | |||
45 mg (N = 21) Estudo PNFP-345 | Midazolam | ||||
7,5mg dose única no Dia 15 | ↓26% | ↓26% | |||
45 mg (N = 24) Estudo PNFP-038 | Ranitidina | ||||
| 150 mg duas vezes ao dia por 7 dias | ↑1% | ↓1% | |||
45 mg diariamente por 4 dias (N = 24) Estudo PNFP-040 | Nifedipina liberação modificada | ||||
30 mg diariamente por 4 dias | ↓13% | ↓17% | |||
45 mg (n = 25) Estudo PNFP-039 | Atorvastatina Cálcica | ||||
| 80 mg diariamente por 7 dias | ↓14% | ↓23% | |||
45 mg (N = 22) Estudo OPI-510 | Teofilina | ||||
| 400 mg duas vezes por dia por 7 dias | ↑2% | ↑5% | |||
*Diariamente por 7 dias salvo disposição ao contrário.
† % de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam o aumento ou redução da exposição, respectivamente.
‡O Cloridrato de Pioglitazona não possui efeito clínico significante no tempo de protrombina.
Tabela 12: Efeitos da coadministração de Cloridrato de Pioglitazona na exposição sistêmica o Cloridrato de Pioglitazona
Fármaco coadministrado e regime de dose | Cloridrato de Pioglitazona | ||
| Regime de dose (mg)* | Alteração na ASC† | Alteração no Cmáx† | |
Genfibrozila 600mg duas vezes ao dia por 2 dias (N = 12) Jaakota at al 2005 | 15 mg dose única | ↑3,2 vezes | ↑6% |
Cetoconazol 200mg duas vezes ao dia por 7 dias (N = 28) Study OPI - 517 | 45 mg | ↑34% | ↑14% |
Rifampicina 600mg diariamente por 5 dias (N = 10) Jaakota et al 2005 | 30 mg dose única | ↓54% | ↓5% |
Fexofenadina 60mg duas vezes por dia por 7 dias (N = 23) Study PNFP-037 | 45 mg | ↑1% | 0% |
Ranitidina 150mg duas vezes por dia por 4 dias (N = 23) Study PNFP-038 | 45 mg | ↓13% | ↓16% |
Nifedipina liberação modificada 30 mg diariamente por 7 dias (N = 23) Study PNFP-40 | 45 mg | ↑5% | ↑4% |
Atorvastatina Ca 80mg diariamente por 7 dias (N = 24) Study PNFP-039 | 45 mg | ↓24% | ↓31% |
Teofilina 400mg duas vezes por dia por 7 dias (N = 22) Study OPI-510 | 45 mg | ↓4% | ↓2% |
*Diariamente por 7 dias salvo disposição ao contrário.
Razão média (com/sem fármaco coadministrado e sem alteração = 1 vez);
% de alteração (com ou sem coadministração de fármaco e sem alterações = 0%); símbolos de ↑ e ↓ indicam o aumento ou redução da exposição, respectivamente.
Como guardar Actos?
Mantenha na embalagem original. Guarde em temperatura ambiente (15-30ºC). Proteja da umidade. Mantenha os frascos bem fechados.
Se armazenado corretamente, o remédio permanecerá próprio para uso até a data de validade impressa na embalagem.
Número de lote e datas: vide embalagem.
Não use após o vencimento. Guarde na embalagem original.
Características físicas
Actos® 15 mg
Comprimidos redondos, convexos, brancos a quase brancos, com "15" de um lado e "ACTOS" do outro.
Actos® 30mg
Comprimidos redondos, convexos, brancos a quase brancos, com "30" de um lado e "ACTOS" do outro.
Actos® 45mg
Comprimidos redondos, convexos, brancos a quase brancos, com "45" de um lado e "ACTOS" do outro.
Antes de usar, verifique o aspecto do remédio. Se notar mudanças, consulte o farmacêutico.
Mantenha fora do alcance de crianças.
Dizeres Legais
MS: 1.0553.0238
Farm. Resp.:
Ana Paula Antunes Azevedo
CRF-RJ nº 6572
Registrado por:
Abbott Laboratórios do Brasil Ltda.
Rua Michigan, 735
São Paulo – SP
CNPJ 56.998.701/0001-16
SAC
0800 703 1050
Fabricado por:
Takeda Pharmaceutical Company Limited.
Osaka - Japão
Importado e Embalado (cartucho) por:
Abbott Laboratórios do Brasil Ltda.
Rio de Janeiro – RJ
Indústria brasileira
Embalado (frasco) por:
Abbott Laboratories de Argentina S.A.
Buenos Aires - Argentina
Ou
Registrado por:
Abbott Laboratórios do Brasil Ltda.
Rua Michigan, 735
São Paulo – SP
CNPJ 56.998.701/0001-16 SAC 0800 703 1050 Fabricado por: Takeda Pharmaceutical Company Limited.
Osaka - Japão
Importado e Embalado por:
Abbott Laboratórios do Brasil Ltda.
Rio de Janeiro - RJ
Indústria brasileira
Ou
Registrado por:
Abbott Laboratórios do Brasil Ltda.
Rua Michigan, 735
São Paulo – SP
CNPJ 56.998.701/0001-16
SAC
0800 703 1050
Fabricado por:
Takeda Pharmaceutical Company Limited.
Osaka - Japão
Importado por:
Abbott Laboratórios do Brasil Ltda.
Rio de Janeiro – RJ
Indústria brasileira
Embalado por:
Abbott Laboratories de Argentina S.A.
Buenos Aires - Argentina
Comercializado por:
Takeda Pharma Ltda.
São Paulo – SP
Sob licença exclusiva de Takeda Pharmaceutical Company Limited - Japão.
Venda sob prescrição médica.

 Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 30 de julho de 2025.
Revisado clinicamente por: Isabelle Baião de Mello Neto (CRF-MG 24309). Atualizado em: 30 de julho de 2025.